томский государственный университет |
кафедра органической химии |
АМИНОКИСЛОТЫ-ПЕПТИДЫ-БЕЛКИ |
Аминокислоты- производные карбоновых кислот, имеющие аминогруппу в a- положении. Классифицируются по строению, характеру заряженности и заменимости-незаменимости.
Классификация по строению.
а) моноаминомонокарбоновые;
б) диаминомонокарбоновые;(лизин, аргинин, цитруллин)
в) моноаминодикарбоновые (аспарагиновая и глутаминовая кислоты);
г) диаминодикарбоновые (цистин).
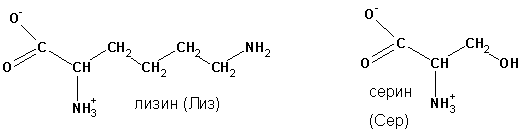
Название по номенклатуре IUPAC формируется, как у карбоновых кислот, с перечислением имеющихся в углеродной цепи заместителей. Например, аминокислота лизин, имеющая строение:
|
будет называться 2,6-диаминогексановая, а серин, соответственно, 2-амино-3-гидроксипропановая кислота. Названия по номенклатуре IUPAC по отношению к протеиногенным аминокислотам не применяют, используя тривиальные названия.
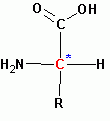
Важным свойством аминокислот является строение бокового радикала R, поскольку остальная часть молекулы, включающая карбоксильную группу, аминогруппу, асимметрический атом углерода и водород для всех протеиногенных аминокислот одинакова:
|
Наличие в боковом радикале R функциональных групп, таких, как сульфгидрильная –SH, карбаминовая H2N-C(=O)- , гидроксильная HO- , аминогруппа H2N-, карбоксильная HOOC- и некоторые другие, имеет значение не только при формировании вторичной, третичной и четвертичной структур белковой молекулы, но и влияет на биологические функции. В водных средах при различных значениях рН эти группы отвечают за формирование электрических зарядов белковой молекулы, ее растворимость и ряд других свойств. Например, замена одного-единственного аминокислотного остатка (глутаминовой кислоты в положении 6) в полипептидной цепи бета-субъединицы гемоглобина на остаток аминокислоты валин (b6 GLU - VAL) приводит к такому изменению свойств молекулы гемоглобина, что это вызывает патологию, называемую “серповидноклеточная анемия”.
По характеру заряженности боковых радикалов аминокислоты подразделяют на:
а) неполярные гидрофобные (ГЛИ, АЛА, ВАЛ, ЛЕЙ, ИЛЕ, ПРО, ФЕН, ТРИ, МЕТ);
б) полярные, но незаряженные (СЕР, ТРЕ, ЦИС, АСН, ГЛН, ТИР);
в) полярные с отрицательным зарядом (АСП, ГЛУ);
г) полярные с положительным зарядом (ЛИЗ, АРГ, ГИС).
В зависимости от того, могут ли аминокислоты синтезироваться в организме или должны поступать в составе пищи, различают:
а) ЗАМЕНИМЫЕ,
б) НЕЗАМЕНИМЫЕ АК (лейцин, изолейцин, валин, лизин, гистидин, метионин, фенилаланин, треонин, триптофан). В детском возрасте также незаменимой является АК АРГИНИН.
Для человека АРГ, ТИР- полузаменимые.
ПРОТЕИНОГЕННЫЕ и НЕПРОТЕИНОГЕННЫЕ АМИНОКИСЛОТЫ
Кислотно-основные свойства (рКа) и изоэлектрические точки (pI) СТЕРЕОХИМИЯ АМИНОКИСЛОТ
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКОВОЙ МОЛЕКУЛЫ
ВЕРНУТЬСЯ НА НАЧАЛЬНУЮ СТРАНИЦУ
©khassanov, MMII-MMXV |