томский государственный университет |
кафедра органической химии |
РЕКОМБИНАНТНЫЕ ДНК И БИОТЕХНОЛОГИЯ |
КЛИНИЧЕСКИЕ ПРИМЕНЕНИЯ PCR
КЛОНИРОВАНИЕ
ПРОЦЕДУРА RT-PCR
SOUTHERN, WESTERN, NORTHERN BLOTS
SSCP-ПОЛИМОРФИЗМ ОДНОЦЕПОЧЕЧНОЙ КОНФОРМАЦИИ ДНК
Dot Blot и определение специфичных генов (Hb-S)
МЕТОДЫ НАКОПЛЕНИЯ ДНК
ЦЕПНАЯ РЕАКЦИЯ ПОЛИМЕРАЗЫ
(POLYMERASE CHAIN REACTION- PCR)
Техника PCR получила развитие в связи с появлением рестриктаз и термически устойчивых ДНК-полимераз (Taq DNA polymerase from Thermus aquaticus). PCR позволяет накапливать участки ДНК, в том числе с неизвестной последовательностью нуклеотидов, для дальнейшего изучения даже в присутствии значительных количеств примесных ДНК, при этом степень накопления может составлять до миллиона раз. Осуществляется в несколько этапов.
1. Подходящий плазмидный вектор разрезается рестриктазами (одной, либо двумя).Теми же рестриктазами разрезается ДНК, в результате чего получаются отрезки различной длины с липкими или тупыми концами. 2. Полученные отрезки смешивают и дают возможность совмещения (annealing), после чего комплементарно соединенные отрезки подвергают воздействию ДНК-лигазы, для замыкания фосфорно-диэфирных связей. 3. Проба нагревается до 90 град. С для денатурации полученных рекомбинантных плазмид, в результате чего происходит разделение комплементарных кольцевых цепей. Проба быстро охлаждается, чтобы предотвратить ренатурацию. 4. В образец добавляют 2 полинуклеотидных праймера, комплементарных участкам ПЛАЗМИДЫ, НЕПОСРЕДСТВЕННО СВЯЗАННЫМ СО ВСТАВКОЙ ИССЛЕДУЕМОГО УЧАСТКА ДНК, добавляются все 4 dNTP, ДН К- Полимераза, ДНК-лигаза. 5. По происшествии времени, достаточного для завершения достраивания комплементарных цепей рекомбинантных плазмид, повторяют пункты 3 и 4. Количество циклов обычно составляет около 20. Добавление свежих порций ДНК-Полимеразы при каждом цикле не требуется, благодаря термической устойчивости Taq DNA- полимеразы. За двадцать циклов PCR удается увеличить количество исследуемого материала ДНК примерно в миллион раз. “ГНЕЗДОВАЯ” PCR Обычно выполняется при исследовании или обнаружении очень малых количеств ДНК. Заключается в том, что после 2-4 циклов обычной PCR, в смесь добавляется новая пара праймеров, комплементарных концам цепей плазмиды, контактирующих со вставкой ДНК, но короче первоначальных праймеров, и размещающихся “внутри” них, словно в гнезде, располагаясь “впритык” к вставке ДНК. Осуществляется еще около 20 циклов нагрев-охлаждение. |
1. Нахождения в организме чужеродных ДНК (вирусов и др.), особенно на ранних этапах заболевания, когда общеизвестные методы ИФА дают серонегативную реакцию (т. н. серонегативное состояние) и требуется быстрый результат.
В частности, это имеет отношение к идентификации вируса СПИД, когда требуется высокая чувствительность и экспрессность при анализах донорской крови.
2. Размножение ДНК из имеющегося в наличии микроколичества биологического материала (высохшее кровяное пятно, отдельный волос, сперма, слюна и т.д.) для последующего анализа на RFLP методом SOUTHERN BLOT.
Несмотря на кажущуюся простоту исполнения, PCR требует исключительных условий для проведения, когда места сбора, обработки и собственно анализа образцов пространственно разделены. Вследствие высокой чувсвительности часто дает неоднозначные результаты при небрежном исполнении. Положительные пробы на PCR требуют дополнительных анализов методом Western blot.
The PCR process is covered by U.S. patents 4,683,195 and 4,683,202 owned by Hoffmann-La Roche Inc. Use of the PCR process requires a license. |
Бактерии очень часто имеют основную геномную ДНК (двухнитевую, кольцевую) размером около 4 млн. пар оснований и, дополнительно к ней, меньшую, кольцевую двухнитевую ДНК размером 3-7 тыс. пар оснований, называемую плазмидой. Плазмиды реплицируют независимо от основной ДНК и могут присутствовать в числе от ДЕСЯТКОВ до ТЫСЯЧ копий на клетку. Основное назначение плазми д - придание бактерии свойств антибиотикорезистентности. На этих свойствах плазмид и основан метод клонирования.
Простейшей и первой из известных плазмид являлась pSC101, выделенная из E.Coli. Однако , ее недостатком являлось наличие всего одной зоны рестрикции, и только один участок, ответственный за устойчивость к антибиотикам (что сильно ограничивает возможности отбора целевых рекомбинантных плазмид). К тому же, она плохо размножается. Однако , на ее основе были синтезированы ряд других плазмид с требуемыми свойствами, называемые векторами.
ПЛАЗМИДНЫЙ ВЕКТОР pBR322
Вектор имеет два участка антибиотикорезистентност и - устойчивости к ТЕТРАЦИКЛИЦУ и АМПИЦИЛЛИНУ и несколько зон рестрикции. Разрезание вектора по сайтам Bam H I, Sal I или Bsp M I с последующей вставкой в него участка размножаемой ДНК, приводит к потере устойчивости бактерии к тетрациклину. Так же, как и в случае PCR, пользуются одной или двумя рестриктазами, имеющими сай т(ы) в требуемом участке. После рекомбинации с отрезками ДНК, полученными в результате воздействия ТЕХ ЖЕ рестриктаз, образец подвергается действию ДНК-лигазы. Полученные плазмиды вводятся в клетки E. Coli путем кратковременного воздействия на них солей двухвалентных металлов. Процесс введения рекомбинантной плазмиды в клетку бактерии называют трансформированием. При этом возможно получение четырех результатов:
1. Клетка получает ИСХОДНУЮ нерекомбинированную плазмиду.
2. Клетка получает ЦЕЛЕВУЮ РЕКОМБИНАНТНУЮ плазмиду.
3. Клетка получает рекомбинированную плазмиду, но со вставкой, не представляющей интереса.
4. Клетка НЕ ПОЛУЧАЕТ НИКАКУЮ плазмиду.
После перенесения клеток в питательную среду, содержащую АМПИЦИЛЛИН,
размножаться будут ТОЛЬКО ПЕРВЫЕ ТРИ типа КЛЕТОК, имеющие плазмиды с генами устойчивости к ампициллину. Клетки, НЕ
ПОЛУЧИВШИЕ плазмиды, не размножаются. Это
используется для выделения целевой колонии бактерий, НЕСУЩЕЙ рекомбинантные плазмиды. С
поверхности агарового геля, на котором выращивались колонии в среде с
АМПИЦИЛЛИНОМ, посредством касания нитроцеллюлозовым фильтром переносится точная копия расположения колоний на стерильный агаровый
слой, содержащий ТЕТРАЦИКЛИН. В таких условиях растут только клетки, содержащие
НЕРЕКОМБИНИРОВАННЫЕ плазмиды. Сравнением расположения
колоний определяются КОЛОНИИ бактерий с рекомбинированными плазмидами.
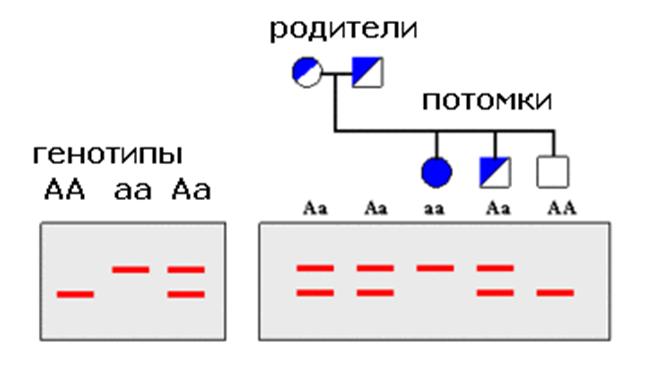
Для определения колоний бактерий, несущих ЦЕЛЕВЫЕ рекомбинантные плазмиды, приходится отличить их от колоний, также несущих рекомбинированные плазмиды, но с нецелевыми вставками. Для этого с ПЕРВОЙ агаровой пластины переносится копия на НЦ-фильтр с последующим лизисом колоний и денатурации плазмидных ДНК щелочью. После этого проводится ГИБРИДИЗАЦИЯ с РАДИОАКТИВНОЙ ПРОБОЙ, комплементарной интересуемому участку ИССЛЕДУЕМОЙ ДНК. Интересуемая колония может быть зарегистрирована (и отделена от нецелевых колоний) по радиоактивности.
ПРОБА --- олигонуклеотид (обычно 15-17 пар оснований), помеченный радиоактивным 32P dNTP или 35S dNTP (дезоксинуклеозидтрифосфатом).
ГИБРИДИЗАЦИЯ есть взаимодействия
взаимно комплементарных участков интересуемой ДНК и
радиоактивной ПРОБЫ.
ПРОЦЕДУРА RT-PCR Обратная танскрипция и получение кДНК из мРНК для дальнейшего размножения материала
С обнаружением реверс-транскриптазы (энзима, способного синтезировать ДНК на матрице РНК) у некоторых вирусов, появилась возможность копирования клеточной мРНК во фрагменты ДНК, которые далее можно размножать либо клонированием, либо PCR для детального изучения, а также для производства праймеров и олигонуклеотидов. Объединенная процедура обратной транскрипции мРНК в кДНК с последующим размножением материала PCR получило наименование RT-PCR.
мРНК в клетках имеются в количествах от одной до нескольких копий на клетку, но их достаточно легко выделять и очищать.
К выделенной из клетки мРНК добавляют тимидиловый праймер (из 12-18 нуклеотидов), который хорошо прилипает к адениловому "хвосту" мРНК. После добавления реверс-транскриптазы и 4 дезоксинуклеотидов начинается процесс построения комплементарной цепи ДНК на матрице РНК. После того, как построение комплементарной цепи заканчивается, гибрид мРНК и кДНК денатурируют либо нагревом, либо обработкой щелочами. В результате образуется однонитевой фрагмент кДНК, у которого имеется участок для начала синтеза второй комплементарной цепи (так называемая hairpin loop- петля типа "рыболовный крючок"). В раствор однонитевого фрагмента достаточно добавить фрагмент ДНК полимеразы I (фрагмент Кленова) и четыре дезоксинуклеотида, чтобы начался синтез комплементарной цепи двунитевой кДНК. Петлевой конец кДНК отрезается по окончании синтеза при помощи S1 нуклеазы. Полученный двунитевой фрагмент кДНК в принципе готов для процедуры PCR. |
Для осуществления операции клонирования его нужно подготовить для внедрения в вектор. Для этого при помощи лигазы к двунитевому фрагменту кДНК с петлей на одном конце вначале пришивают линкер с зоной рестрикции RE1. После этого эндонуклеазой S1 отрезается петлевой конец и к уже обоим тупым концам пришивается по другому линкеру RE2. После обработки полученного фрагмента одновременно двумя рестриктазами RE1 и RE2 получается готовый двунитевой фрагмент ДНК, который можно вставить в подобранный заранее вектор (с зонами рестрикции RE1 и RE2) в правильном направлении и в нужном месте. |
SOUTHERN, WESTERN, NORTHERN BLOTS
ПРОЦЕДУРА SOUTHERN BLOT И ОСУЩЕСТВЛЯЕМЫЙ НА ОСНОВЕ ЕЕ АНАЛИЗ ПОЛИМОРФИЗМА ДЛИН РЕСТРИКЦИОННЫХ УЧАСТКОВ (RESTRICTION FRAGMENT LENGHT POLYMORPHISM--- RFLP)
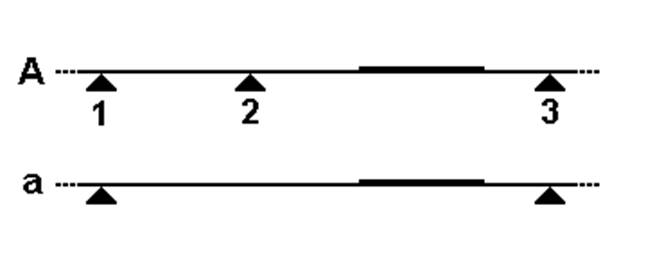
При разрезании геномной ДНК рестриктазой количество зон рестрикции зависит от числа мутаций, в результате которых может происходить исчезновение зон рестрикций. Ниже приведен пример, иллюстрирующий, каким образом мутация в гене приводит к исчезновению зоны рестрикции и удлинению меченого радиоактивностью фрагмента однонитевой ДНК:
У верхнего фрагмента имеется три зоны рестрикции, в то время как у нижнег о- только 2 (зона №2 отсутствует из-за мутации). Соответственно, помечаемый радиоактивностью участок (утолщение) имеет большую длину и отличную от первого участка подвижность в гель-электрофорезе:
Красными полосками показаны фрагменты, меченые радиоактивной пробой. Разделение на картинке идет сверху вниз, более мелкие фрагменты продвигаются ближе к низу, длинные "застревают" вверху. Аллели А имеют малые размеры меченых фрагментов и наблюдаются внизу электрофореграммы. Аллели а длинные и остаются в верхней части Электрофореграммы. Если у индивидума присутствуют оба вида аллелей, наблюдаются две полосы. |
Полиморфизм одноцепочечной конформации
SINGLE STRANDED CONFORMATION POLYMORPHISM- (SSCP)
Существуют патологии, вызываемые заменой всего одного-единственного нуклеотида в цепи, и не регистрируемые RFLP, поскольку замена произошла ВНЕ ЗОНЫ РЕСТРИКЦИИ. При подозрении на патологии такого рода, ДНК разрезается на более мелкие осколки (не более 400 пар). Даже единичная замена нуклеотидов заметно влияет на величину продвижения отрезка в электрофоретическом поле, и может быть, таким образом, идентифицирована.
Одинаковые (по количеству пар нуклеотидов) двунитевые фрагменты ДНК не разделяются в гель электрофорезе. Однако получаемые в результате денатурации третичные структуры их однонитевых фрагментов имеют совершенно разные размеры в пространстве вследствие различных внутринитевых взаимодействий. Замена одного единственного нуклеотида может существенно влиять на размер третичной структуры:
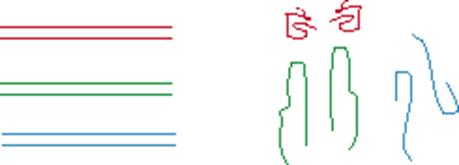
В результате достигается разделение в гель-электрофорезе (вызванное, фактически единственной нуклеотидной заменой):
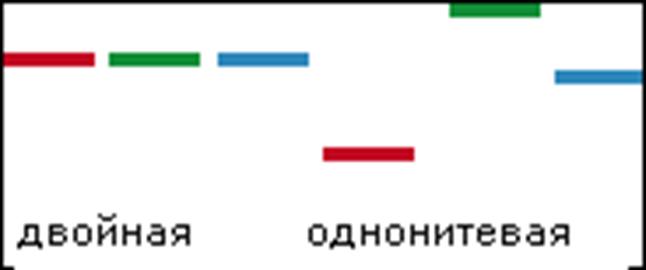
Для усиления сигнала пользуются теми же приемами, что и в технике PCR:

• Подбирается пара праймеров (под нужный полиморфизм)
• Один из праймеров (А) берется в большом избытке
• Когда исчерпается минорный праймер (В), копироваться будет только одна цепь
Как следствие, становится возможным регистрация мутации. Ниже приведена фотография гель-электрофореграммы из реального примера анализа однонитевых фрагментов (цифрами между полосами обозначены количества замен нуклеотидов между соответствующими фрагментами). Хорошо заметна различная подвижность в геле:
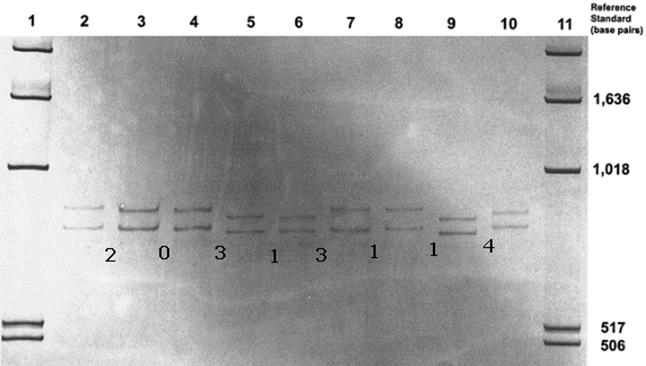
Ограничения SSCP
•Сильная зависимость подвижности от температуры.
• Чувствительность зависит от рН. Добавка глицерина повышает качество определений (Kukita et al., 1997).
• На анализ влияет длина фрагментов. Оптимально – 150-300 п.о. (Wagner, 2002).
•В оптимальных условиях SSCP детектируется от 80 до 90% потенциальных замен (Wagner, 2002).
Dot Blot и определение специфичных генов (Hb-S)
Dot blot (или slot blot)является техникой молекулярной биологии, используемой для детектирования биомолекул. Оно является упрощенной версией методов северного, южного и западного блотов (Northern blot, Southern blot, or Western blot). Для детектирования в dot blot нет нужды предварительно разделять молекулы гель-электрофорезом или каким-нибудь другим способом. Вместо этого, смесь, в которой содержатся и детектируемые молекулы, наносится непосредственно на мембрану в виде пятна через трафарет. После чего осуществляется детектирование либо олигонуклеотидной пробой (как в northern blot и southern blot) или антителами (как в western blot).
Эта техника существенно упрощает и ускоряет определения, но не дает информации о самой молекуле. Она только сигнализирует о наличии в смеси молекул определенного рода. Например, два белка разной ММ массы дадут оодин единственный сингал в одном пятне.
Аллель-специфичные олигонуклеотиды (ASO)
Аллель-специфичные олигонуклеотиды (ASO) являются короткими отрезками синтетической однонитевой ДНК, комплементарной к последовательности на целевой (геномной) ДНК. Используется в качестве пробы, поскольку может гибридизоваться (комплементарно присоединяться) к определенным участкам ДНК в геноме. Будучи маркирована радиоактивными изотопами атомов или красителем, она позволяет обнаруживать присутствие или отсутствие ДНК с интересуемой последовательностью нуклеотидов, характерной для того или иного генетического заболевания и мутации. ASO чаще всего представялет собой олигонуклеотид из 15-21 основания. Конструируется он таким образом, чтобы быть специфичным только для одной версии, или аллеля, тестируемой ДНК. Пробы ASO обычно конструируются таким образом, чтобы детектировалос различие в один нуклеотид. Принцип действия ASO можно понять из приведенных ниже примеров обнаружения генов серповидноклеточной анемии, возникающей в результате мутации ДНК заменой триплета нуклеотидов G-A-G на G-T-G:

Таким образом, проба (ASO "S" проба) на наличие генов измененной ДНК ("S" ДНК серповидноклеточной анемии) прочно взаимодействует лишь со "своей" мутировавшей ДНК (верхний комплекс) и слабо- с "нормальной" "А" ДНК (нижний комплекс). Соответственно, альтернативная проба для нормальной ДНК ("А" проба) будет слабо взаимодействовать с мутировавшей "S" ДНК и прочно- с нормальной "А" ДНК. В процессе ДОТ блоттинга слабо взаимодействующие комплексы смываются и не дают сигналов. Если в геноме присутствуют оба аллеля, ДОТ блот даст сигнал в обоих комбинациях. Для этого выполняют анализ с двумя пробами:

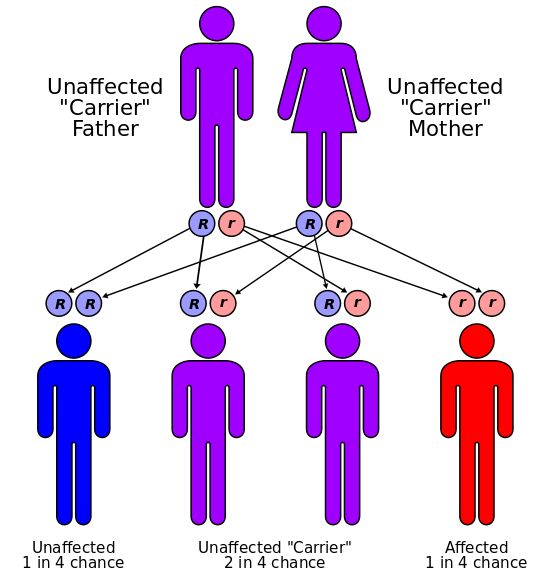
Цифрами 1-6 на рисунке обозначены образцы от различных субъектов. По результатам можно заключить, что у субъектов 1 и 4 имеются только нормальные аллели генов, у субъектов 2 и 6 - только мутировавшие аллели (подвержены заболеванию), а субъекты 3 и 5 являются гетерозиготными по указанному признаку. Их потомство может оказаться (с вероятностью в 25%) подверженным заболеванию:
процессинг нуклеиновых
кислот
секвенирование ДНК
экспрессия ДНК в эукариотических системах
нуклеиновые кислоты
вернуться на начальную
страницу
© khassanov, MMII-MMXVIII |