томский государственный университет |
кафедра органической химии |
СЕКВЕНИРОВАНИЕ ДНК |
I. ПРОЦЕДУРА МАКСАМА-ГИЛБЕРТА (MAXAM-GILBERT)
Процедура была впервые описана в феврале 1977 года в журнале Proceedings of the National Academy of Sciences (США):

Процедура начинается с получения участка ДНК при расщеплении ее двумя различными рестриктазами. При этом образуются нетождественные “липкие” концы. Полученный двунитевой фрагмент ДНК после очистки на ПААГ делится на две порции, каждая из которых маркируется селективно радиоактивными нуклеотидами, комплементарными крайнему основанию на 5’-конце.
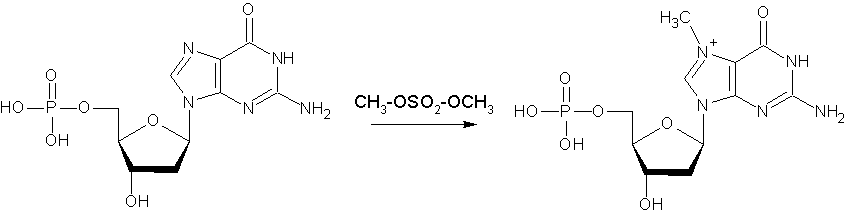
Реакция катализируется фрагментом ДНК-Полимеразы 1 бактерии E.Coli, (Klenow Fragment). Фрагмент Кленова получается частичным протеолизом ДНК-Полимеразы 1 E. Coli и обладает лишь активностью катализировать продолжение полинуклеотидной цепи в направлении 5’-3’. Немеченная радиоактивностью цепь далее в регистрации не будет видна. Проба делится на 4 части и обрабатывается химически с целью разрушения одного или двух азотистых оснований. На сегодняшний день есть возможность селективно разрушать либо только пуриновые основания (А+G), либо только пиримидиновые (С+T), либо только Гуанин (G), либо только Цитозин (С). Пока не найдено способа разрушения только А или только Т.
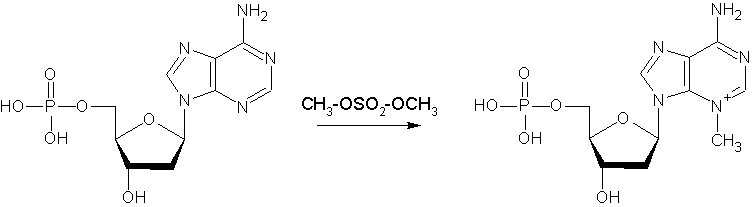
Более или менее селективное разрушение достигается вследствие разной способности пуриновых оснований к метилированию и последующему гидролизу с разрывом N-гликозидной связи (отщепление азотистого основания). Диметилсульфат метилирует остатки Гуанина в ДНК по N7, а Аденина- по N3. Гликозидная связь метилированных пуриновых остатков становится нестабильной и легко расщепляется при небольшом нагревании в нейтральной среде, оставляя сахар свободным от азотистого основания. Обработка 0,1 М щелочью гидролизует обе фосфатные связи углевода, освобождая его.
| Гуанин легче метилируется диметилсульфатом (в положение 7): |
|
| Аденин метилируется труднее и в положение 3. Но 3-метилпроизводные аденина легче гидролизуются. Изменением условий метилирования и гидролиза можно добиваться некоторой селективности разрушения азотистых оснований. |
|
Разрушение пиримидиновых азотистых оснований происходит при действии
гидразина.
При этом тимин разрушается
гидразином, а цитозин- гидразином в присутствии хлорида натрия:

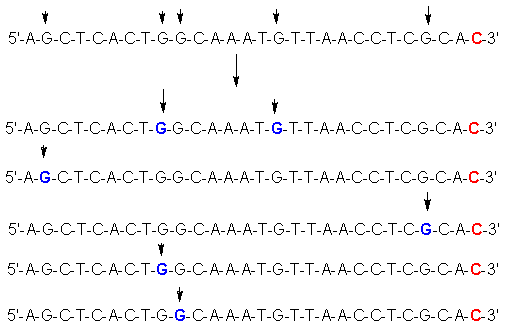
Разрушение азотистых оснований происходит случайным образом. Однако гидролиз ДНК (разрыв фосфоэфирных связей) протекает тотально, по местам всех разрушенных оснований.
Добиваться селективности в отношении гуаниновых и адениновых азотистых оснований можно, меняя условия гидролиза. Гликозидная связь метилированного аденина менее стабильна, чем у метилированного гуанина, поэтому осторожная обработка разбавленными кислотами высвобождает преимущественно адениновые азотистые основания. Последующее щелочное расщепление сахарофосфатной цепи у мест разрушенныхоснований приводит к появлению на электрофореграммах темных полос у остатков с расщепленным аденином и светлых- гуанином.:
Аденин/Гуанин – CH3-OSO2-OCH3 (метилирование по N3 Аденина, N7 гуанина), затем тотальный гидролиз у (случайно) разрушенных оснований.- Аденин/Гуанин – CH3-OSO2-OCH3 (метилирование), затем мягкий кислотный гидролиз (при 0 С) разбавленной HCl (0,5 М).
При электрофорезе продуктов гидролиза (и последующей регистрации засвечиванием фотопленки радиоактивной меткой) наблюдаются темные и светлые полосы. (Точнее, черные и «недостаточно черные»- серые полосы. Поскольку степень засветки фотоматериала пропорциональна количеству источника радиации). Темные полосы принадлежат осколкам, полученным при расщеплении по местоположению гуанина, который метилируется в 5 раз быстрее Адениновых оснований. В полученных электрофореграммах содержится уже половина информации о последовательности нуклеотидов, однако расшифровка темных и светлых полос не всегда однозначна, поэтому Максам и Гилберт параллельно проводили еще один эксперимент, в котором расщепление гуаниновых оснований было подавлено.
Расщепление по местам Цитозина и Тимина.
Гидразин взаимодействует с остатками Тимина и Цитозина с образованием рибозилмочевины. Гидразин способен реагировать и глубже, с образованием гидразонов. После частичного гидразинолиза при 200 С в 15-18 М водном гидразине, ДНК расщепляется полумолярным пиперидином. Этот вторичный амин замещает все продукты реакции гидразина с углеводом. Полосы на электрофореграмме получаются одинаковой интенсивности для Тимина и цитозина. Более селективное расщепление только цитозиновых азотистых оснований достигается в 1,5-2,0 М NaCl.
|
Гидролиз протекает по местам разрушенных оснований (показаны синим). В смеси можно добиться всех вариантов разрушений. Разделение полученных отрезков разной длины проводят гель-электрофорезом, при этом регистрируются только помеченные радиоактивностью отрезки (на рисунке показанное серым шрифтом не регистрируется):
|
Ниже показаны реальные результаты секвенирования:
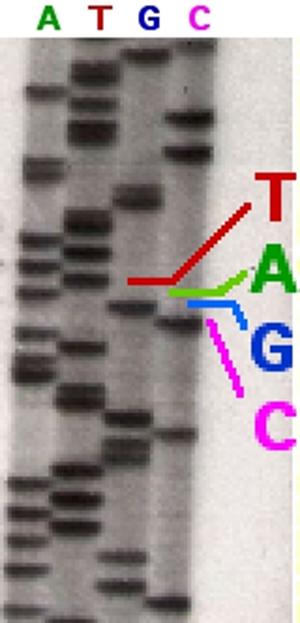
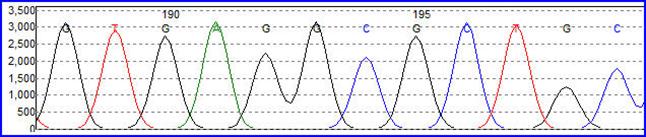
При этом получаются детектируемые по радиоактивности отрезки, которые разделяются электрофорезом на ПААГ . Более короткие цепи продвигаются быстрее по гелю, более тяжелые - медленнее. Идентификация полос осуществляется авторадиографом.
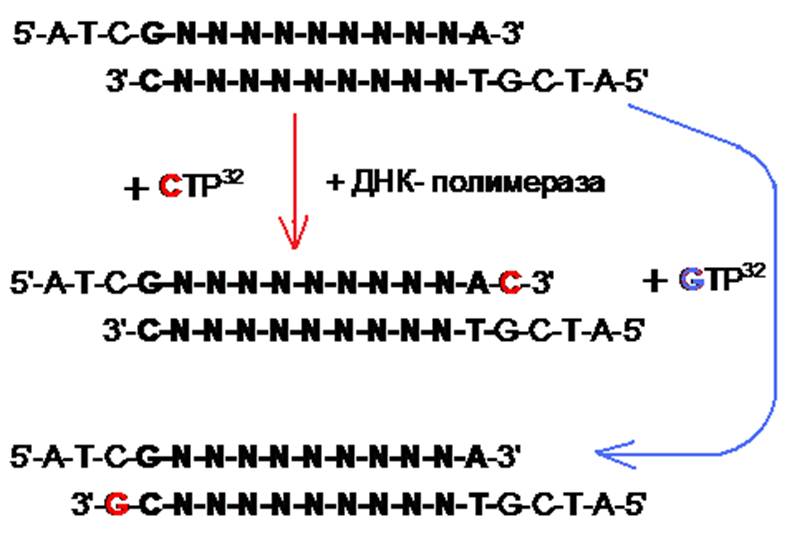
1. Выделяется фрагмент однонитевой ДНК, последовательность в которой следует определить и к ней пришивается так называемый “универсальный праймер”, помеченный радиоактивностью 32Р или 35S. Образец делится на 4 части и помещается в пробирки, в каждой из которых имеются все 4 трифосфонуклеотида (dTNP) и по одному дидеоксинуклеотиду (ddTNP), у которого отсутствует гидроксил при 3’ атоме углерода рибозы, следовательно, за ней продолжение цепи невозможно. Дидеоксинуклеотиды конкурируют в реакции продолжения цепи с обычными нуклеотидами,
в результате они встраиваются в растущую цепь в различных местах и в итоге
получается смесь из комплементарных цепей различной длины, которая разделяется электрофорезом на ПААГ и
регистрируется авторадиографом. |
ВЕРНУТЬСЯ НА НАЧАЛЬНУЮ СТРАНИЦУ
ВЕРНУТЬСЯ НА НУКЛЕИНОВЫЕ КИСЛОТЫ
© khassanov, MMII-MMXIV |