Замещение атомов водорода в молекулах алканов на любой гетероатом (галоген, азот, серу, кислород и т.д) или группу вызывает перераспределение электронной плотности. Природа этого явления различна. Она зависит от свойств гетероатома (его электроотрицательности)
и от типа связей, по которым это влияние распространяется. Если влияние заместителя передается при участии
F > O > N
F > Cl > Br > J
В случае заместителей с полным зарядом отрицательный индуктивный эффект увеличивается с возрастанием электроотрицательности атома, связанного с углеродом:
>O+- > >N+<
В случае сложных заместителей отрицательный индуктивный эффект определяется природой атомов, составляющих заместитель. Кроме этого индуктивный эффект зависит от характера гибридизации атомов. Так, электроотрицательность атомов углерода зависит от гибридизации электронных орбиталей:
sp3 < sp2 < sp
Положительный индуктивный эффект проявляют: элементы, менее электроотрицательные, чем углерод, группы с полным отрицательным зарядом, алкильные группы. +
I – эффект уменьшается в ряду:(СН
3)3С- > (CH3)2CH- > CH3-CH2- > CH3- > H-Индуктивный эффект заместителя быстро затухает по мере увеличения длины цепи.
Наличие заместителя со свободной парой электронов или вакантной р-орбиталью, присоединенного к системе, содержащей
p-электроны, приводит к возможности смешения р-орбиталей заместителя (занятых или вакантных) с p-орбиталями и перераспределению электронной плотности в соединениях. Такой эффект называется мезомерным.Смещение электронной плотности обычно незначительно и длины связей практически не меняются. О незначительном смещении электронной плотности судят по дипольным моментам, которые даже в случае больших эффектов сопряжения на крайних атомах сопряженной системы невелики.
Мезомерный эффект изображают изогнутой стрелкой, направленной в сторону смещения электронной плотности:
В зависимости от направления смещения электронного облака мезомерный эффект может быть положительным (+М) и отрицательным (-М). Положительный мезомерный эффект уменьшается при увеличении электроотрицательности атома, несущего неподеленную пару электронов, вследствие снижения тенденции отдавать ее, а также при увеличении объема атома:
Положительный мезомерный эффект уменьшается в том случае, если атом связан с группой-акцептором электронов:
-NH2 > -NH-CO-CH3
Отрицательный мезомерный эффект возрастает с увеличением электроотрицательности атома и достигает максимальных значений, если атом-акцептор несет заряд:
>C=O+H >> >C=O
Уменьшение отрицательного мезомерного эффекта наблюдается в случае, если группа- акцептор сопряжена с донорной группой:
Эффект, подобный положительному мезомерному
, возникает при замещении алкильной группой водорода у кратной связи. Этот эффект направлен в сторону кратной связи и называется гиперконъюгацией (сверхсопряжением):СН3 > CH3-CH2 > (CH3)2CH > (CH3)3C
Сводная таблица заместителей и их электронных эффектов
|
Заместитель или группа атомов |
Эффекты |
СН3 > CH3-CH2 > (CH3)2CH |
+ I, +M (заместители I рода, электронодоноры индуктивным и мезомерным эффектами, орто-пара-ориентанты в реакциях SЕ) |
(CH3)3C |
+ I, M=0 (заместители I рода, электронодонор индуктивным эффектом, орто-пара-ориентант в реакциях SE) |
Атом, присоединенный к p- системе, имеет неподеленную пару электронов: X- (галоген), -O-, -OH, -OR, -NH2, -NHR, -NR2, -SH, -SR, |
- I, +M (заместители I рода, электронодоноры мезомерным эффектом, орто-пара-ориентанты в реакциях SЕ) |
присоединенный к p- системе атом в свою очередь связан с более электроотрицательным атомом: -N=O, -NO2, -SO3H, -COOH, -CO-H, -CO-R, -CO-OR, -CN, -CX3, -C=N=S, |
- I, -M (заместители II рода, электроноакцепторы индуктивным и мезомерным эффектами, мета-ориентанты в реакциях SЕ) |
|
Винильные и фенильные группы: -СН=СН-, -С6Н4- (фенилен) (легко передают М-эффект в любом направлении) |
I=0 (по отношению к углероду sp2), -I (по отношению к sp3), +/-M (орто-, пара- ориентанты, способны принимать и отдавать электроны при взаимодействии с сопряженной с ними p-системой) |
|
Атом, не имеющий р-орбиталей, но с полным положительным зарядом -NH3+, -NR3+ , |
- I, M=0 (заместители II рода, электроноакцепторы индуктивным эффектом, мета-ориентанты в реакциях SЕ, поскольку дестабилизируют сигма-комплекс в орто- и пара- положениях) |
При рассмотрении таблицы можно вывести простое эмпирическое правило для определения рода заместителя:
1. Если с р-системой связан более электроотрицательный элемент, то группировка относится к заместителям 1 рода:
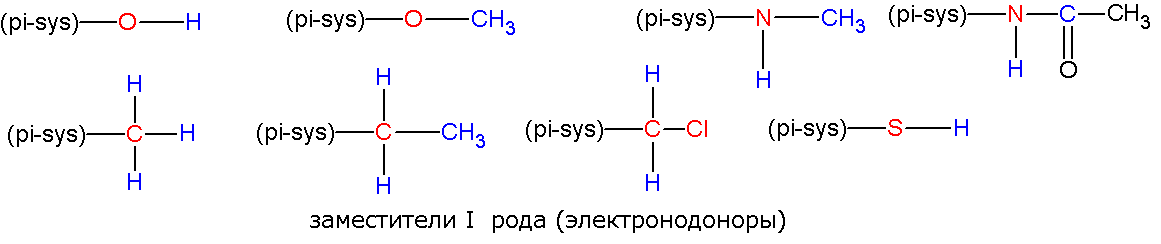
2. Если с р-системой связан менее электроотрицательный элемент, то группировка относится к заместителям 2 рода:
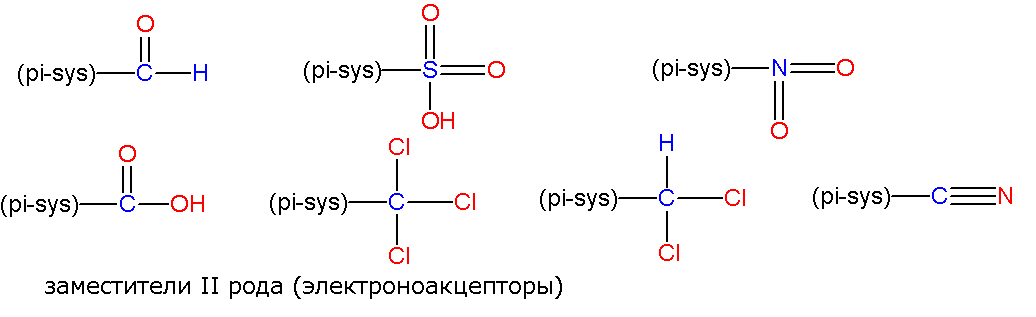
3. Все заместители 1 рода обладают +М эффектом (за исключением трет-бутильной группировки, которая не имеет мезомерного эффекта)
4. Все заместители 2 рода обладают -М эффектом (за исключением четвертичного азота, третичных кислорода и серы, которые не имеют мезомерного эффекта).
Особую группу составляют заместители с полными зарядами, которые в соответствии со знаком заряда являются обычно либо донорами электронов (анионы), либо акцепторами (катионы).
На рисунке ниже показаны некоторые из заместителей (группировок атомов), вид и относительная величина их индуктивных эффектов, а также влияние на протекание реакций электрофильного замещения в ароматических системах (ускорение или замедление).
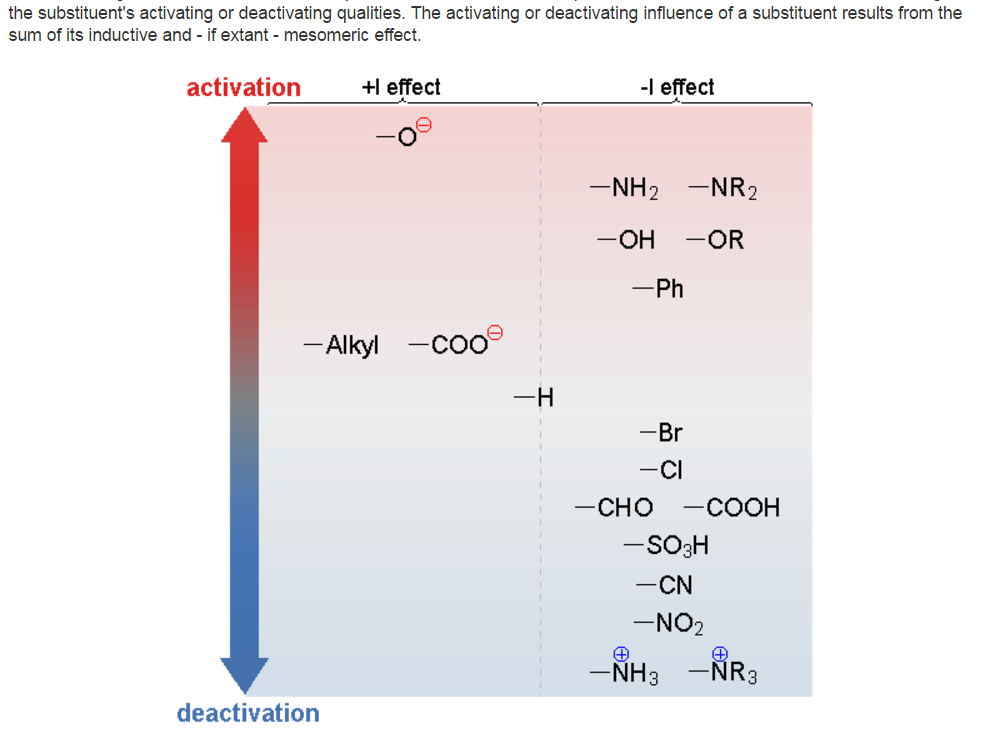
ПРАВИЛА ОРИЕНТАЦИИ В АРОМАТИЧЕСКИХ СИСТЕМАХ
ВЕРНУТЬСЯ НА НАЧАЛЬНУЮ СТРАНИЦУ