При реакции бензола (типичной ароматической системы) все шесть положений для вхождения замещающей водород группы равнозначны и затруднений здесь не возникает. Однако, вхождение каждого следующего заместителя подчиняется определенным закономерностям, а именно, зависит от типа атакующей частицы и уже имеющегося в кольце заместителя. Наиболее распространенными типами реакций в ароматике являются электрофильное и нуклеофильное замещения. В первом случае атакующей ароматическую систему является электронодефицитная частица (электрофил), имеющая полный положительный заряд или недостаток электронной плотности на одном из атомов. При атаке такая частица “отыскивает” область в кольце, обогащенную электронной плотностью. При нуклеофильном замещении атакующей частицей является нуклеофил, отрицательно заряженная или нейтральная частица с избытком электронной плотности в виде неподеленной пары электронов. Нуклеофил стремится войти в место, обедненное электронной плотностью. Остается разобраться, каким образом влияют на общую электронную плотность и ее распределение в кольце имеющиеся в нем заместители. В таблице представлены наиболее часто встречающиеся заместители. Сводная таблица заместителей и их электронных эффектов
| Заместитель или группа атомов |
Ориентация при SEAr |
Эффекты |
|
СН 3 > CH3-CH2 > (CH3)2CH |
о-, п- ориентация ,(галогены- дезактивирующие) |
+ I, +M |
|
(CH3)3C |
+ I, M=0 |
|
|
Атом, присоединенный к p- системе, имеет неподеленную пару электронов:X- (галоген), -O-, -OH, -OR, -NH2, -NHR, -NR2, -SH, -SR, |
- I, + M |
|
|
присоединенный к p- системе атом в свою очередь связан с более электроотрицательным атомом:-N=O, -NO2, -SO3H, -COOH, -CO-H, -CO-R, -CO-OR, -CN, -CX3 |
м- ориентация, с дезактивированием |
- I, -M |
|
sp2-гибридизованный углерод: -СН=СН-, -С 6Н5 (фенил) |
о-, п- ориентация |
I=0, +M (стирол, флуорен ) |
|
Атом, не имеющий р-орбиталей, но с полным положительным зарядом -NH3+, -NR3+ , |
м- ориентация, с дезактивированием |
- I, M=0 |
Все они влияют на ОДНИ И ТЕ ЖЕ положения в кольце, но с различным результатом. Часть из них, которые имеют +М и
+I эффекты, увеличивают электронную плотность в кольце в целом, и по о- и п- положениям относительно себя, в частности. Распределение электронной плотности в кольце описывается резонансными структурами:Они являются АКТИВИРУЮЩИМИ реакцию электрофильного замещения о- и п- ориентантами (заместители
I рода). Галогены, благодаря наличию у них +М- эффекта также являются ориентантами I рода (о-, п-), но вследствие сильного –I эффекта они понижают реакционную способность бензольного кольца в реакциях электрофильного замещения. Замещение в активированных системах протекает намного легче замещения в бензоле и в о- и п- положения относительно замсетителя первого рода:Заместители с полным положительным зарядом (
-N+R3), а также имеющие отрицательный мезомерный эффект (-М), который всегда сопровождается наличием отрицательного индуктивного эффекта (-I), снижают электронную плотность в кольце в общем и о-, п- положениях, в частности:Поэтому они являются дезактивирующими реакцию электрофильного замещения м- ориентантами. Это означает что электрофильное замещение в системе с такими заместителями затруднено и протекает только в сравнительно незатронутые м- положения кольца. Такие заместители относят к заместителям II рода:
На рисунке ниже показаны некоторые из заместителей (группировок атомов), вид и относительная величина их индуктивных эффектов, а также влияние на протекание реакций электрофильного замещения в ароматических системах (ускорение или замедление):
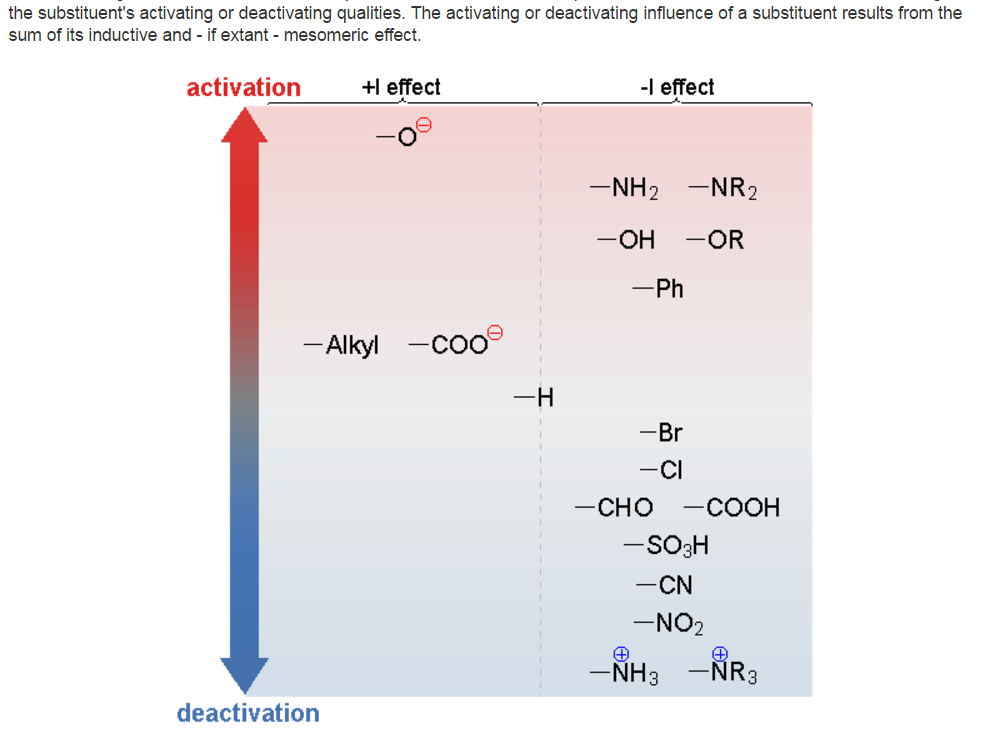
Заместители II рода реакции нуклеофильного замещения облегчают, снижая электронную плотность в кольце и на замещаемом атоме:
Подобными упрощенными схемами можно пользоваться при решении вопроса о месте вступления заместителя при наличии в кольце других группировок, но более строгим приемом является написание возможных структур сигма-комплексов и оценка их стабильности. К примеру, только таким способом можно оценить ориентирующее влияние таких группировок, как трет-бутил (СН3)3С- или четвертичный азот (CH3)3+N- .
Так, несмотря на отсутствие +М эффекта у трет-бутильной группировки, она является выраженным о-, п- ориентантом, что легко доказать написанием резонансных структур сигма-комплексов, из которых очевидно следует, что вхождение заместителя в орто- и пара- положения приводит к образованию более стабильных сигма- комплексов (стабилизация +I эффектом трет-бутильной группы),
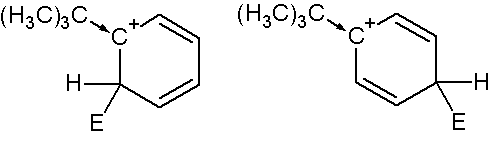
чем при образовании комплекса в мета-положении, где нет прямого влияния заместителя:
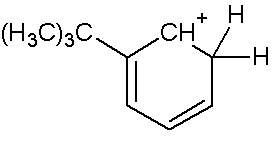
Аналогичные структуры можно написать для сигма комплексов с четвертичным атомом азота.
ВЕРНУТЬСЯ НА НАЧАЛЬНУЮ СТРАНИЦУ