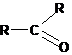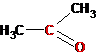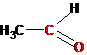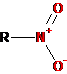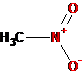томский государственный университет |
кафедра органической химии |
Cтроение и реакционная способность органических соединений. Теория строения органических соединений |
Основные положения теории химического строения Бутлерова
Типы связей в молекулах органических веществ
Типы реакций в органической химии
Классификация органических соединений
Гомологи и гомологические ряды
Изомерия органических соединений
Электронные эффекты в молекулах органических соединений
Органическая химия имеет исключительно важное познавательное и народнохозяйственное значение.
Природные органические вещества и их превращения лежат в основе явлений Жизни. Поэтому органическая химия является химическим фундаментом биологической химии и молекулярной биологии – наук, изучающих процессы, происходящие в клетках организмов на молекулярном уровне. Исследования в этой области позволяют глубже понять суть явлений живой природы.
Множество синтетических органических соединений производится промышленностью для использования в самых разных отраслях человеческой деятельности – это нефтепродукты, горючее для различных двигателей, полимерные материалы (каучуки, пластмассы, волокна, пленки, лаки, клеи и т.д.), поверхностно-активные вещества, красители, средства защиты растений, лекарственные препараты, вкусовые и парфюмерные вещества и т.п. Без знания основ органической химии современный человек не способен грамотно использовать все эти продукты цивилизации.
Сырьевыми источниками органических соединений служат нефть и природный газ, каменный и бурый угли, горючие сланцы, торф, продукты сельского и лесного хозяйства.
Критерием деления соединений на органические и неорганические служит их элементный состав.
К органическим соединениям относятся химические вещества, содержащие в своем составе углерод, например:
CH3-CN, CH3-CH2-OH, CS2, CH3COOH, CH3-NH2, CH3-NO2, CH3-COOC2H5.
Органические соединения отличаются от неорганических рядом характерных особенностей:
· почти все органические вещества горят или легко разрушаются при нагревании с окислителями, выделяя СО2 (по этому признаку можно установить принадлежность исследуемого вещества к органическим соединениям);
· в молекулах органических соединений углерод может быть соединен почти с любым элементом периодической системы;
· органические молекулы могут содержать последовательность атомов углерода, соединенных в цепи (открытые или замкнутые);
· молекулы большинства органических соединений не диссоциируют на достаточно устойчивые ионы;
· реакции органических соединений протекают значительно медленнее и в большинстве случаев не доходят до конца;
· среди органических соединений широко распространено явление изомерии;
· органические вещества имеют более низкие температуры фазовых переходов (т. кип., т. пл.).
Органических соединений насчитывается гораздо большее количество, чем неорганических.
Основные положения теории химического строения Бутлерова
1. Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
2. Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы).
3. Свойства веществ зависят от их химического строения.
4. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы – предвидеть свойства.
5. Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Уже с того момента, когда исследователи научились определять элементный состав соединений, было замечено, что часто соединения с одинаковым элементным составом обладают совершенно разными химическими и физическими свойствами. Выявление причин такого поведения стимулировало создание теории строения органических соединений. Впервые такая теория была сформулирована А.М. Бутлеровым.
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
Строение атома углерода
Очевидно, что все реакции, в которые вступают органические молекулы, связаны со строением атома углерода конкретной молекулы и перестройкой его внешних валентных орбиталей в процессе превращений.
В невозбужденном состоянии атом углерода имеет 2 электрона на s-орбитали второго подуровня (2s-орбитали), а также 2 электрона на двух (из всего 3) p-орбиталей 2 подуровня (2px- и 2py-орбиталях):
2s |
2px |
2py |
2pz |
↑↓ |
↑ |
↑ |
В результате получения энергии извне атом углерода переходит в возбужденное состояние, когда один из 2s-электронов переходит на энергетически более высокую 2р-орбиталь:
2s |
2px |
2py |
2pz |
↑ |
↑ |
↑ |
↑ |
Таким образом, на внешних орбиталях у углерода имеется 4 электрона, способных к образованию связей. Согласно теории, формы s- и р-орбиталей описывают вероятность нахождения электрона относительно ядра атома. Негибридизованные s- и р-орбитали имеют формы сферы и равномерной «гантели» и располагаются в пространстве согласно нижеприведенной схеме:

При образовании соединений из атомарного углерода (или в составе соединений углерода) происходит изменение формы и расположения в пространстве относительно ядра атома внешних орбиталей углерода, называемое гибридизацией. Схематически гибридизацию можно представить таким образом:
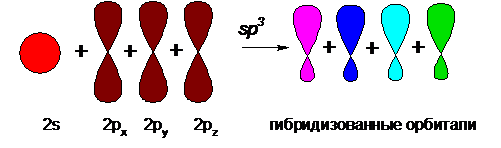
Из четырех негибридизованных атомных s- и р-орбиталей, имеющих разную форму, в результате sp3-гибридизации (что означает изменение одной s- и трех р-орбиталей) получаются четыре равноценных по энергии и форме гибридизованные молекулярные орбитали, имеющие форму искаженной гантели.
Для обеспечения минимальных стерических затруднений и взаимного отталкивания эти четыре равноценные орбитали расположены в пространстве на равных друг от друга расстояниях, направлены к вершинам тетраэдра (ядро атома углерода располагается в центре тетраэдра), а пространственные углы между орбиталями составляют около 109°28’:
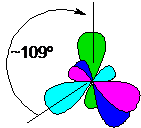
В таком состоянии четыре связи в результате перекрывания орбиталей могут быть образованы беспрепятственно. В такой гибридизации углерод присутствует (исключительно) в составе алканов, циклоалканов и спиртов.
Таким образом, например, выглядит молекула этана (желтыми сферами показаны атомы водорода, точнее, их s-орбитали):
Связь между атомами углерода образована перекрыванием гибридизованных орбиталей. Такие связи называют s-связями (сигма-связями). Вокруг s-связи возможно вращение фрагментов молекулы.
Гибридизация – изменение формы и расположения в пространстве относительно ядра атома его внешних электронных орбиталей, при образовании связей с другими атомами. Другое определение: гибридизация – смешение орбиталей, в результате которого происходит их выравнивание по форме и энергии.
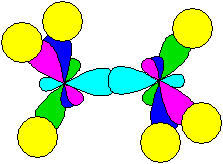
Атом углерода, имеющий при себе кратную связь (алкены -С=С-, карбонильные соединения >C=O, карбоновые кислоты и их производные -СООН, -COOR и т.д.), имеет другую гибридизацию (sp2), соответственно, форму и расположение в пространстве внешних орбиталей:
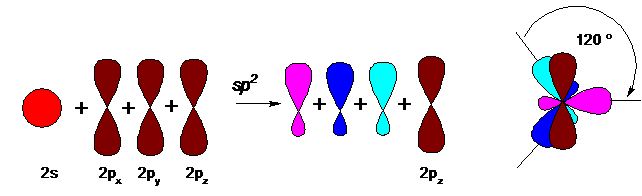
В состоянии sp2-гибридизации при углероде имеется только 3 гибридизованных орбитали (полученные из одной s- и двух р-орбиталей), которые расположены в одной плоскости под углом 120° между ними, а четвертая (негибридизованная) р-орбиталь располагается перпендикулярно этой плоскости. Двойная связь образуется в результате перекрывания негибридизованных орбиталей между соседними атомами углерода (или между углеродом и кислородом), на рисунке представлена молекула этилена (этена):
Связи, образуемые перекрыванием негибридизованных р-орбиталей, называют p-связями. Таким образом, кратная (двойная) связь в молекуле этена образована одной сигма- и одной пи-связью.
Вращение фрагментов молекулы вокруг p-связи по понятным причинам при нормальной температуре невозможно (необходима дополнительная энергия на разрыв перекрывающихся р-орбиталей), это обуславливает наличие пространственных (геометрических) изомеров у алкенов, при наличии некоторых дополнительных условий, о которых будет сказано ниже.
На рисунке негибридизованные р-орбитали находятся на расстоянии – разнесены искусственно, для лучшего восприятия, хотя в реальности они «соприкасаются» друг с другом, перекрываясь сверху и снизу, но образуя только одну дополнительную связь.
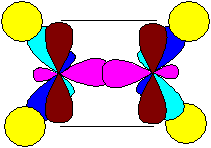
Углерод при тройной связи (в алкинах и нитрилах) находится в состоянии sp-гибридизации:
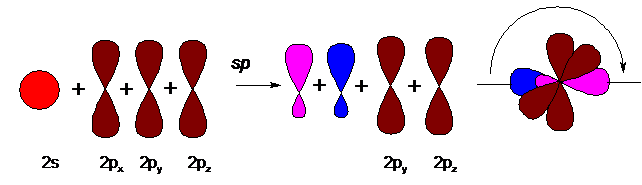
Пара гибридизованных орбиталей расположена в линию, под углом 180° и противоположно направлена. Две негибридизованные р-орбитали, согласно принципу минимального отталкивания и для минимизации стерических затруднений, расположены перпендикулярно этой линии и под углом 90° между собой. Тройная связь в алкинах образуется в результате перекрывания гибридизованных орбиталей (одна s-связь) и двух негибридизованных р-орбиталей соседних атомов углерода (две p-связи). Так, например, выглядит модель молекулы ацетилена (этин):
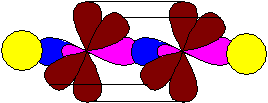
В результате протекания реакций углерод способен как менять, так и сохранять состояние своей гибридизации.
Типы связей в молекулах органических веществ
Преобладающим типом связи в молекулах органических соединений является ковалентная связь. Пара электронов связи поделена между атомами в примерно равной степени, если характеризовать связи С-С или С-Н. Это вызвано примерно равным сродством к электрону (электроотрицательностью) атомов С и Н.
В случае, когда углерод связан с более электроотрицательным атомом (галогены, кислород, азот), связь может быть в значительной степени поляризована, а на атомах могут образовываться частичные положительные (на углероде) и отрицательные (на атомах галогенов, кислорода, азота) заряды. Однако степень ионности такой связи минимальна.
Вследствие неполярности связи С-С и С-Н преимущественным способом ее разрыва является гомолитический, когда пара электронов делится поровну между атомами. При таком разрыве связи образуются незаряженные, но очень реакционно-способные частицы с неспаренными электронами, называемые радикалами. Для алканов очень характерны реакции с промежуточным образованием радикалов. Инициируются такие превращения введением извне энергии, достаточной для разрыва связи (нагрев) или соединений, инициирующих образование радикалов при слабом нагревании или облучении ультрафиолетом (перекиси, галогены, азосоединения, химические инициаторы, генерирующие радикалы в результате химической реакции). В общем и целом, алканы и циклоалканы с ненапряженными циклами химически относительно инертны.
В отличие от них, алкены значительно более реакционноспособны. Причиной этого является ненасыщенность (кратная связь) и доступность рыхлой электронной плотности перекрывающихся р-орбиталей p-связи для действия электрофильных реагентов (соединений с пустыми внешними орбиталями или электронодефицитных соединений). В результате происходит исчезновение кратной связи и присоединение электрофилов. Реакции протекают с промежуточным образованием положительно заряженных интермедиатов (карбкатионов) или радикалов.
Другая группа реакций связана с поляризацией связи углерод-галоген, кислород или азот. Эти реакции имеют более сложный механизм и зависимость от строения субстрата, реагента и условий реакции (растворитель, катализатор и т.д.).
Существуют и более сложные типы реакций (циклоприсоединение или реакция Дильса–Альдера), детальный механизм которых изучен пока не во всех тонкостях.
Типы реакций в органической химии
Таким образом, можно различить всего несколько типов реакций, в которые вступают органические соединения:
1) реакции замещения, когда один атом (или группировка атомов) замещаются другим атомом (или группировкой атомов). Углеродный скелет при этом остается неизменным. Реакции протекают через предварительный разрыв связи с последующим образованием новой;
2) реакции присоединения. Характерны для соединений, имеющих ненасыщенность (кратные связи), в результате чего возможно присоединение других молекул (водорода, воды, галогенов, кислорода, галогеноводородов и т.д.);
3) реакции отщепления (элиминирования), когда от молекулы органического соединения отщепляются молекулы (воды, аммиака, галогенов, галогеноводородов, водорода, СО, СО2 и т.д.). Такие реакции часто носят наименование по виду отщепляемой молекулы, соответственно, дегидратация, дезаминирование, дегалогенирование, дегидрогалогенирование, дегидрирование, декарбонилирование, декарбоксилирование и т.д.;
4) реакции конденсации, когда происходит укрупнение углеродного скелета молекулы;
5) реакции крекинга (или расщепления), в результате которых происходит расщепление углеродного скелета на более мелкие молекулы;
6) реакции окисления, сопровождающиеся удалением молекул водорода (частный случай реакции отщепления), или с одновременным внедрением молекул кислорода (превращение спиртов в альдегиды и кетоны и, далее, в кислоты);
7) реакции изомеризации (или перестройки углеродного скелета или циклов);
8) реакции полимеризации, в результате которой из мелких молекул (мономеров) получаются длинные неразветвленные молекулы полимеров. В живой природе известны примеры образования разветвленных полимерных молекул, структурными единицами в которых выступают органические молекулы моносахаридов (углеводов).
Классификация органических соединений
Несмотря на многообразие органических соединений, основу их молекул составляют цепи и кольца, образованные из атомов углерода. Соединения, в состав которых входят только углерод и водород, называются углеводородами. При этом часть валентностей углерода затрачивается на образование связей с соседними атомами углерода, а свободные валентности связывают углерод с водородом, кислородом, азотом, серой и, значительно реже, с другими атомами периодической системы. Очень часто такой «скелет» из атомов углерода сохраняется в результате химических превращений, претерпеваемых молекулой органического соединения, что значительно облегчает предсказание состава продуктов. Часто реакции ограничиваются заменой одного или нескольких атомов водорода на другой элемент или группу атомов (по другому называемой группировкой или функциональной группой), в результате чего получается органическое соединение другого класса. В зависимости от группировки, заменившей один из атомов водорода в молекуле органического соединения в результате реакции, различают классы органических соединений.
Часто в результате реакции происходит замена одной функциональной группы на другую, при сохранении углеродного скелета. Однако известны и многочисленные реакции, сопровождающиеся изменением углеродного скелета молекулы.
Таблица
Некоторые функциональные группы органических соединений
Функциональная группа |
Название группы |
Класс соединений |
Общая структура |
Примеры |
-Cl, -F, -Br, -I (-Х) |
Галоген |
Галогениды |
R-X |
Бромбензол |
Этенилхлорид (винилхлорид) |
||||
-ОН |
Гидроксил (окси, гидрокси) |
Спирты, фенолы |
R-OH |
Фенол |
Метанол |
||||
>С=О |
Карбонил (оксо) |
Альдегиды, кетоны |
|
Пропанон (ацетон)
Этаналь (ацетальдегид) |
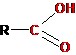
-СООН |
Карбоксил (карбокси) |
Карбоновые кислоты |
|
Этановая кислота (уксусная кислота) |
-NO2 |
Нитро |
Нитросоединения |
|
Нитрометан |
-NH2 |
Амино |
Амины |
|
Аминометан (метиламин) |
-CN |
Циано |
Нитрилы |
|
Этаннитрил (ацетонитрил) |
Гомологи и гомологические ряды
Гомологи – органические соединения (одного класса, см. выше), различающиеся на одну или несколько метиленовых групп (звеньев -СН2-). Гомологами у алканов являются, например, метан, этан, пропан, бутан и т.д., у которых число атомов углерода изменяется на единицу (или на такое же число метиленовых звеньев).
Гомологами ароматических соединений являются бензол, толуол, ксилолы, мезитилен, этилбензол и прочие алкилзамещенные бензолы. Эти соединения по брутто-формуле также различаются на одно или несколько метиленовых звеньев (-СН2-). Соответственно, гомологами являются метанол, пропанол и этанол, ацетон и метилэтилкетон, уксусная и пропионовая кислоты и т.д.
Изомерия органических соединений
Формула строения (структурная формула) описывает порядок соединения атомов в молекуле, т.е. ее химическое строение. Химические связи в структурной формуле изображают черточками. Связь между водородом и другими атомами обычно не указывается (такие формулы называются сокращенными структурными).
Структурные формулы отличаются от молекулярных (брутто) формул, которые показывают только, какие элементы и в каком соотношении входят в состав вещества (т.е. качественный и количественный элементный состав), но не отражают порядка связывания атомов. Например, н-бутан и изобутан имеют одну молекулярную формулу C4H10, но разную последовательность связей.
Таким образом, различие веществ обусловлено не только разным качественным и количественным элементным составом, но и разным химическим строением, которое можно отразить лишь структурными формулами. Еще до создания теории строения были известны вещества одинакового элементного состава, но с разными свойствами. Такие вещества были названы изомерами, а само это явление – изомерией. В основе изомерии, как показал А.М. Бутлеров, лежит различие в строении молекул, состоящих из одинакового набора атомов. Таким образом, изомерия – это явление существования соединений, имеющих одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства.
Например, при содержании в молекуле 4 атомов углерода и 10 атомов водорода возможно существование двух изомерных соединений:
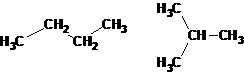
В зависимости от характера отличий в строении изомеров различают структурную и пространственную изомерию.
Структурная изомерия
Структурные изомеры – соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением.
Например, составу C4H8 соответствует 5 структурных изомеров:

Среди органических соединений теоретически возможно существование колоссального количества только структурных изомеров. Так, среди алканов, содержащих только атомы углерода и водорода, число возможных изомеров увеличивается в геометрической прогрессии с увеличением количества атомов углерода. Если для соединения состава С4Н10 возможно существование только двух изомеров, то для пентанов С5Н12 число таких изомеров увеличивается до трех, С6Н14 имеет 5 изомеров, С7Н16 – 9 изомеров, С8Н18 – 18 изомеров, С9Н20 – 35 изомеров, а для соединения пентакозан С25Н52 теоретически возможно существование ни много ни мало- 36 797 588 изомеров.
На приведенном выше примере можно различить следующие изомеры:
- положения двойной связи (бутен-1 и бутен-2);
- углеродного скелета (бутены-1 и -2 и изобутилен);
- размеров цикла (циклобутан и метилциклопропан);
- межклассовые изомеры (алкены и циклоалканы).
Межклассовыми изомерами являются, например, этанол и диметиловый эфир, имеющие одинаковую брутто-формулу С2Н6О, но совершенно разное строение и относящиеся к разным классам. У них различаются не только химические свойства (более инертный диметиловый эфир не реагирует с металлическим натрием, в отличие от этанола), но и физические. Этанол – жидкость при нормальной температуре, тогда как диметиловый эфир – газ.
Циклические и ациклические органические соединения
Можно заметить, что среди структурных изомеров органических соединений могут существовать молекулы, содержащие в своем составе циклы, построенные из атомов углерода разного числа (а часто и не один такой цикл в составе молекулы). На этом основании различают алициклические соединения (содержащие циклы, или просто циклические соединения) и ациклические соединения (циклов не содержащие, а построенные исключительно из цепей атомов углерода, часто разветвленных).
Карбоциклические соединения содержат в цикле только атомы углерода. Они делятся на две существенно различающиеся по химическим свойствам группы: алифатические циклические (сокращенно алициклические) и ароматические соединения.
Гетероциклические соединения содержат в цикле, кроме атомов углерода, один или несколько атомов других элементов – гетероатомов (от греч. heteros – другой, иной) – кислород, азот, серу и др.
Пространственная изомерия
Пространственные изомеры (геометрические изомеры, стереоизомеры) при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле.
Пространственными изомерами являются оптические (зеркальные) и цис-транс-изомеры. В показанном выше примере пространственными изомерами может обладать бутен-2, существующий в природе в виде цис- и транс-бутенов-2:
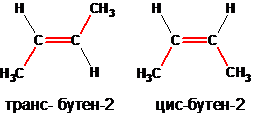
Пространственная изомерия появляется, в частности, тогда, когда углерод имеет четыре разных заместителя:
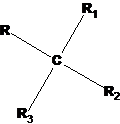
Если поменять местами любые два из них, получается другой пространственный изомер того же состава. Физико-химические свойства таких изомеров существенно различаются. Соединения такого типа отличаются способностью вращать плоскость пропускаемого через раствор таких соединений поляризованного света на определенную величину. При этом один изомер вращает плоскость поляризованного света в одном направлении, а его изомер – в противоположном. Вследствие таких оптических эффектов этот вид изомерии называют оптической изомерией.
Более подробно с оптической изомерией можно познакомиться в разделе кислородсодержащих и азотсодержащих органических соединений.
Оптическая изомерия – частный случай пространственной изомерии. Оптическими изомерами называют различающиеся пространственным расположением группировок и атомов молекулы, имеющие одинаковый состав и одинаковый порядок связи атомов. Растворы таких соединений способны вращать плоскость пропускаемого через них поляризованного света на определенный угол.
1.3.3. Номенклатура органических соединений
Вследствие наличия огромного числа органических соединений огромное значение приобретает система их обозначения (наименования) таким образом, чтобы по названию можно было легко установить его структуру (химическое строение), а соответственно, и все химические и физические свойства. Таким образом, наименование должно максимально точно отражать химическое строение органического соединения, включая возможность идентификации структурных и геометрических изомеров. К настоящему моменту времени сложилось три типа номенклатуры органических соединений:
1. тривиальная;
2. рациональная;
3. систематическая (или заместительная, или номенклатура IUPAC).
Наличие тривиальных названий связано с историей. Ранее исследователи часто давали наименования соединениям по источнику их выделения или по каким-либо органолептическим, физико-химическим свойствам. Тривиальные наименования находятся в обращении иногда на таких же правах (если не чаще), чем систематические названия. Так, например, до сих пор бытует название уксусная кислота, муравьиная кислота, лактоза, мочевина и многие другие названия.
Рациональная номенклатура
Этот тип номенклатуры получил распространение в результате того, что часть соединений может быть названа как некое родоначальное соединение, от которого они отличаются заместителями. Примером может являться неопентан («новый пентан»), углеводород класса алканов состава С5Н12. Название «неопентан» считается тривиальным, и ровным счетом ничего не говорит о его строении. Согласно номенклатуре второго типа, этот углеводород можно назвать тетраметилметаном. Название тетраметилметан уже значительно более информативно в смысле сведений о строении молекулы. Можно представить себе молекулу метана, у которой все четыре атома водорода заменены метильными группами.
Систематическим же названием неопентана является наименование 2,2-диметилпропан, составленное по правилам, разработанным Международным союзом чистой и прикладной химии (IUPAC – International Union of Pure and Applied Chemistry). Структурная формула неопентана приведена ниже:
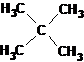
Детальное рассмотрение правил наименования органических соединений нами будет сделано позднее, при рассмотрении отдельных классов органических соединений, поскольку в каждом случае имеются свои особенности.
Электронные эффекты в молекулах органических соединений
Замещение атомов водорода в молекулах алканов на любой гетероатом (галоген, азот, серу, кислород и т.д.) или группу вызывает перераспределение электронной плотности. Природа этого явления различна. Она зависит от свойств гетероатома (его электроотрицательности) и от типа связей, по которым это влияние распространяется.
Индуктивный эффект
Если влияние заместителя передается при участии s-связей, то происходит постепенное изменение электронного состояния связей. Такая поляризация называется индуктивным эффектом (I), изображается стрелкой в направлении смещения электронной плотности. Электронная плотность всегда смещается в сторону БОЛЕЕ ЭЛЕКТРООТРИЦАТЕЛЬНОГО атома или группы атомов:
СН3-СН2-->Cl,
HO <-- СН2-СН2 --> Cl,
СН3-СН2 --> COOH,
СН3-СН2 --> NO2 и т.д.
Индуктивный эффект обусловлен стремлением атома или группы атомов подавать или оттягивать на себя электронную плотность, в связи с чем он может быть положительным или отрицательным. Отрицательный индуктивный эффект проявляют элементы, более электроотрицательные, чем углерод, т.е. галогены, кислород, азот и другие, а также группы с положительным зарядом на элементе, связанном с углеродом. Отрицательный индуктивный эффект уменьшается справа налево в периоде и сверху вниз в группе периодической системы:
F > O > N,
F > Cl > Br > J.
В случае заместителей с полным зарядом отрицательный индуктивный эффект увеличивается с возрастанием электроотрицательности атома, связанного с углеродом:
>O+- >> N+< .
В случае сложных заместителей отрицательный индуктивный эффект определяется природой атомов, составляющих заместитель. Кроме этого, индуктивный эффект зависит от характера гибридизации атомов. Так, электроотрицательность атомов углерода зависит от гибридизации электронных орбиталей и изменяется в следующем направлении:
sp3 < sp2 < sp.
Положительный индуктивный эффект проявляют элементы, менее электроотрицательные, чем углерод; группы с полным отрицательным зарядом; алкильные группы. +I-эффект уменьшается в ряду:
(СН3)3С- > (CH3)2CH- > CH3-CH2- > CH3- > H-.
Индуктивный эффект заместителя быстро затухает по мере увеличения длины цепи.
Таблица
Сводная таблица заместителей и их электронных эффектов
Заместитель или группа атомов (X- галоген) |
Эффекты |
-СН3 > CH3-CH2- > (CH3)2CH- >> CH2X |
+I, +M |
(CH3)3C- |
+I, M = 0 |
Атом, присоединенный к p-системе, имеет неподеленную пару электронов: X- (галоген), -O-, -OH, -OR, -NH2, -NHR, -NR2, -SH, -SR, |
–I, +M |
присоединенный к p-системе атом, в свою очередь, связан с более электроотрицательным атомом: -N=O, -NO2, -SO3H, -COOH, -CO-H, -CO-R, -CO-OR, -CN, -СНХ2, -CX3, -C=N=S |
–I, –M |
Более электроотрицательный углерод (в сравнении с sp3): -СН=СН-, -С=СН (этинил), -С6Н4- (фенилен) (но легко передают М-эффект в любом направлении) |
–I, M = 0 |
Атом, не имеющий р-орбиталей, но с полным положительным зарядом -N+H3, -N+R3 , (-S+R2 ,-O+H2 ), |
–I, M = 0 |
Мезомерный эффект
Наличие заместителя со свободной парой электронов или вакантной р-орбиталью, присоединенного к системе, содержащей p-электроны, приводит к возможности смешения р-орбиталей заместителя (занятых или вакантных) с p-орбиталями и перераспределению электронной плотности в соединениях. Такой эффект называется мезомерным.
Смещение электронной плотности обычно незначительно и длины связей практически не меняются. О незначительном смещении электронной плотности судят по дипольным моментам, которые даже в случае больших эффектов сопряжения на крайних атомах сопряженной системы невелики.
Мезомерный эффект изображают изогнутой стрелкой, направленной в сторону смещения электронной плотности. Электронная плотность всегда смещается в сторону более электроотрицательного атома, находящегося на краю структуры и связанного с остальной структурой кратной связью:
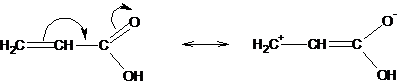
В зависимости от направления смещения электронного облака мезомерный эффект может быть положительным (+М), атом или когда группировка атомов передают электроны в пи-систему:
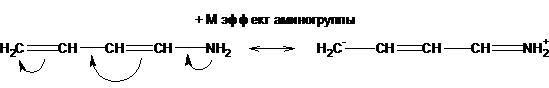
и отрицательным (-М), когда группировка атомов вытягивает электроны из пи-системы:
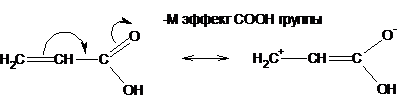
Положительный мезомерный эффект (+М) уменьшается при увеличении электроотрицательности атома, несущего неподеленную пару электронов, вследствие снижения тенденции отдавать ее, а также при увеличении объема атома. Положительный мезомерный эффект галогенов изменяется в следующем направлении:
F > Cl > Br > J (+M-эффект).
Положительным мезомерным эффектом обладают группировки с неподеленными парами электронов на атоме, присоединенном к сопряженной пи-системе:
-NH2 (NHR, NR2) > OH (OR) > X (галоген) (+М-эффект).
Положительный мезомерный эффект уменьшается в том случае, если атом связан с группой-акцептором электронов:
-NH2 > -NH-CO-CH3.
Отрицательный мезомерный эффект возрастает с увеличением электроотрицательности атома и достигает максимальных значений, если атом-акцептор несет заряд:
>C=O+H >> >C=O.
Уменьшение отрицательного мезомерного эффекта наблюдается в случае, если группа- акцептор сопряжена с донорной группой:
-CO-O- << -СО-NH2 < -CO-OR <
-CO-H(R) << -CO-
Таблица
Сводная таблица заместителей и их электронных эффектов
Заместитель или группа атомов (X- галоген) |
Эффекты |
-СН3 > CH3-CH2- > (CH3)2CH- >> CH2X |
+I, +M |
(CH3)3C- |
+I, M = 0 |
Атом, присоединенный к p-системе, имеет неподеленную пару электронов: X- (галоген), -O-, -OH, -OR, -NH2, -NHR, -NR2, -SH, -SR, |
–I, +M |
присоединенный к p-системе атом, в свою очередь, связан с более электроотрицательным атомом: -N=O, -NO2, -SO3H, -COOH, -CO-H, -CO-R, -CO-OR, -CN, -СНХ2, -CX3, -C=N=S |
–I, –M |
Более электроотрицательный углерод: -СН=СН-, -С=СН (этинил), -С6Н4- (фенилен) (но легко передают М-эффект в любом направлении) |
–I, M = 0 |
Атом, не имеющий р-орбиталей, но с полным положительным зарядом -N+H3, -N+R3 , (-S+R2, -O+H2 ), |
–I, M = 0 |
Гиперконъюгация или сверхсопряжение
Эффект, подобный положительному мезомерному, возникает при замещении водорода у кратной связи алкильной группой. Этот эффект направлен в сторону кратной связи и называется гиперконъюгацией (сверхсопряжением):
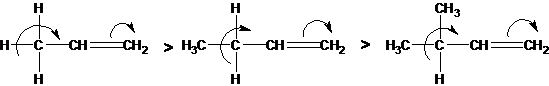
Эффект напоминает положительный мезомерный, поскольку отдает электроны в сопряженную p-систему:
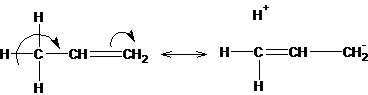
Сверхсопряжение уменьшается в последовательности:
СН3 > CH3-CH2 > (CH3)2CH
> (CH3)
Для проявления эффекта гиперконъюгации необходимо наличие хотя бы одного атома водорода при атоме углерода, соседствующем с p- системой. Трет-бутильная группировка не проявляет этого эффекта, а потому мезомерный эффект ее равен нулю.
Таблица
Сводная таблица заместителей и их электронных эффектов
Заместитель или группа атомов (X- галоген) |
Эффекты |
-СН3 > CH3-CH2- > (CH3)2CH- >> CH2X |
+I, +M |
(CH3)3C- |
+I, M = 0 |
Атом, присоединенный к p-системе, имеет неподеленную пару электронов: X- (галоген), -O-, -OH, -OR, -NH2, -NHR, -NR2, -SH, -SR, |
–I, +M |
присоединенный к p-системе атом, в свою очередь, связан с более электроотрицательным атомом: -N=O, -NO2, -SO3H, -COOH, -CO-H, -CO-R, -CO-OR, -CN, -СНХ2, -CX3, -C=N=S |
–I, –M |
Более электроотрицательный углерод: -СН=СН-, -С=СН (этинил), -С6Н4- (фенилен) (но легко передают М-эффект в любом направлении) |
–I, M = 0 |
Атом, не имеющий р-орбиталей, но с полным положительным зарядом -N+H3, -N+R3 , (-S+R2, -O+H2 ), |
–I, M = 0 |