томский государственный университет |
кафедра органической химии |
Лекция № 2. Алкены, алкадиены, алкины (ненасыщенные углеводороды).
К ненасыщенным (непредельным) углеводородам относятся алкены (СnH2n), алкадиены (CnH2n-2) и aлкины (CnH2n-2), содержащие кратные связи
углерод-углерод. Алкены содержат ОДНУ
двойную связь С=С,
углероды при двойной связи находятся в состоянии гибридизации sp2. Двойная
связь образована перекрыванием:
а) sp2- гибридизованных орбиталей атома углерода (s-связь) и
б) перекрыванием негибридизованных р-орбиталей (p-связь). Алкадиены содержат ДВЕ кратные связи в молекуле. В зависимости от взаимного
расположения кратных связей одна относительно другой, различают:
а) кумулированные диены:
СН3-СН=С=СН-СН2-СН2-СН3 (гептадиен-2,3) или СН3-СН2-СН2-СН=С=СН2 (гексадиен-1,2)
(кратные связи расположены по соседству);б) сопряженные алкадиены (или просто диены, кратные связи расположены
через одну простую):СН3-СН=СН-СН=СН-СН2-СН3 (гептадиен-2,4)в) изолированные диены (кратные связи разделены более, чем одной простой):СН2=СН-СН2-СН2-СН=СН-СН3 (гептадиен-1,5)Все три типа диенов различаются по химическим свойствам. Только
изолированные диены ведут себя как обыкновенные алкены, поскольку кратные связи
не оказывают взаимного влияния в их молекулах.Номенклатура алкенов Номенклатура алкенов весьма сходна с номенклатуроой алканов за тем
исключением, что при наименовании за основу выбирается наиболее длинная цепь
углеродных атомов, ВКЛЮЧАЮЩАЯ в себя КРАТНУЮ связь (выделена красным), цепь
нумеруется с того края, к которому ближе расположена(ы)
кратная(ые) связь(и):
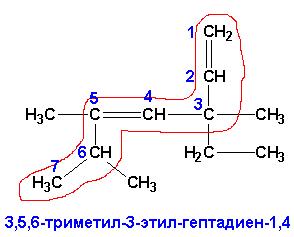
При этом не имеет значения пространственное расположение основной цепи. Название формируется перечислением номеров углеродных атомов основной цепи и имеющихся при них заместителей. Окончание в названии основной углеродной цепи для алкенов заменяется на –ЕН, алкадиенов- на -ДИЕН, положение кратных связей указывается через тире (из двух номеров углеродов, между которыми расположена кратная связь, выбирают НАИМЕНЬШИЙ). В приведенном выше примере соединение будет иметь название: 3,5,6-триметил-3-этил-гептадиен-1,4.Вследствие наличия в молекуле кратной связи, вокруг которой вращение невозможно, алкены и алкадиены могут иметь (а могут и не иметь) пространственные изомеры. Для определения возможности наличия пространственных изомеров следует определить, имеются ли ПРИ КАЖДОМ из двух углеродов кратной связи РАЗНЫЕ ЗАМЕСТИТЕЛИ.
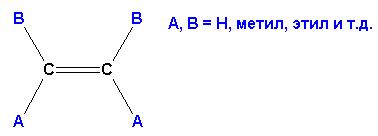
Если требование выполняется, то пространственные изомеры имеются. Если хотя бы у одного из углеродов при кратной связи имеются ОДИНАКОВЫЕ заместители, пространственная изомерия невозможна. В приведенном выше соединении возможно следующее пространственное расположение атомов и групп:
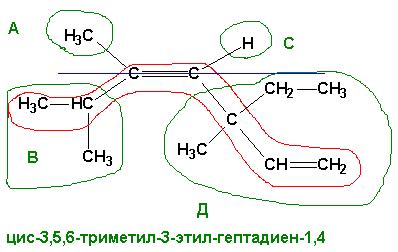
Если основная цепь углеродов расположена ПО ОДНУ СТОРОНУ от оси кратной связи, то такой изомер является ЦИС- изомером, если основная цепь пересекает ось кратной связи (располагается по обе стороны от оси) – это ТРАНС- изомер. Изомерию в данном случае обеспечивает кратная связь между 4 и 5 атомами углерода, в то время как кратная связь между 1 и 2 атомами углерода не может давать различного пространственного расположения заместителей при ней (одинаковые атомы водорода при С1).
Алкины- углеводороды, содержащие тройную связь С=С, углероды при которой находятся в sp-гибридизованном состоянии. Тройная связь образована перекрыванием двух sp-гибридизованных орбиталей (от каждого из углеродов) и четырех негибридизованных р-орбиталей (по две от каждого углерода). Две негибридизованные р-орбитали у каждого из углеродов расположены во взаимно перпендикулярных плоскостях. Номенклатура алкинов подчиняется тем же правилам, что и номенклатура алкенов, за исключением того, что углеводороду основной цепи присваивается окончание –ин:
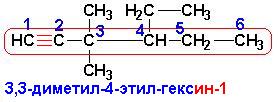
Общие свойства ненасыщенных (непредельных) углеводородов
Общим местом непредельных углеводородов является наличие кратных связей, то есть некоторой степени ненасыщенности, вследствие чего- возможность присоединения ряда реагентов, сопровождающееся разрывом p-связей. Поскольку p-связи являются областями повышенной электронной плотности, к тому же легкодоступными, они становятся легкой “добычей” электронодефицитных реагентов (электрофилов). Поэтому непредельные углеводороды легко реагируют с целым рядом соединений даже на холоду (то есть, без нагревания). Подробный механизм реакций электрофильного присоединения к кратным связям описан отдельно. Там же описаны закономерности присоединения несимметричных реагентов к несимметричным и замещенным алкенам и алкинам. Для алкилзамещенных этиленов и ацетиленов при написании продуктов присоединения следует пользоваться правилом Марковникова, которое гласит, что водород присоединяется к наиболее гидрированному атому углерода при кратной связи):
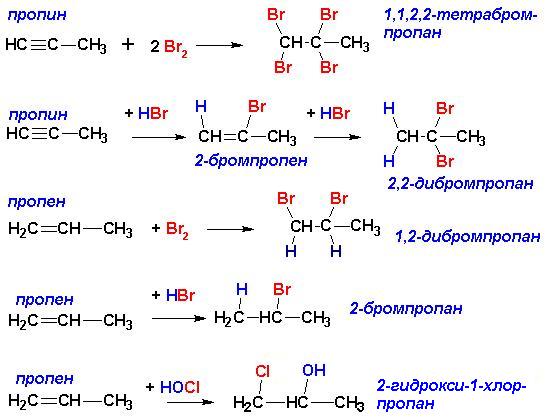
Это правило, справедливое лишь для реакций электрофильного присоединения к алкенам, имеет современное обоснование, позволяющее объяснить аномальное присоединение в случае электроноакцепторных заместителей при кратной связи:
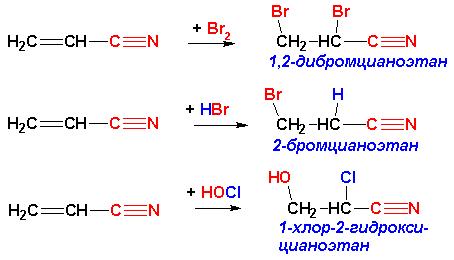
Аналогичным действием наряду с цианогруппой –CN обладают также нитро группа -NO2, нитрозогруппа -N=O, карбонильная группа -C=O, сульфогруппа –SO3H, а также другие группировки, ПРИ УСЛОВИИ, что атом, непосредственно связанный с атомом углерода при кратной связи, НЕ ИМЕЕТ неподеленных пар электронов. В противном случае правило Марковникова не нарушается:
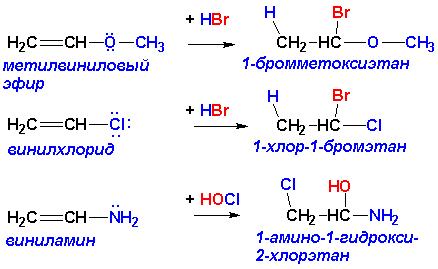
Другие реакции алкенов и алкинов.
Реакции окисления. При взаимодействии с растворами KMnO4 на холоду происходит образование двухатомных спиртов (гликолей) из алкенов:
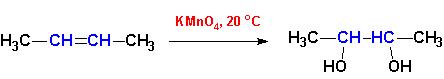
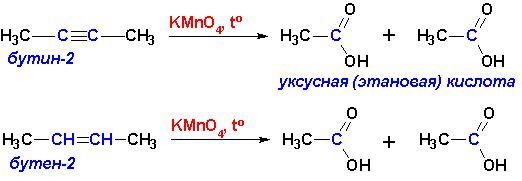
При взаимодействии с горячими растворами KMnO4, а также с энергичными окислителями происходит разрыв молекулы по месту кратной связи и образуются карбоновые кислоты, вне зависимости от того, двойная это была или тройная связь:
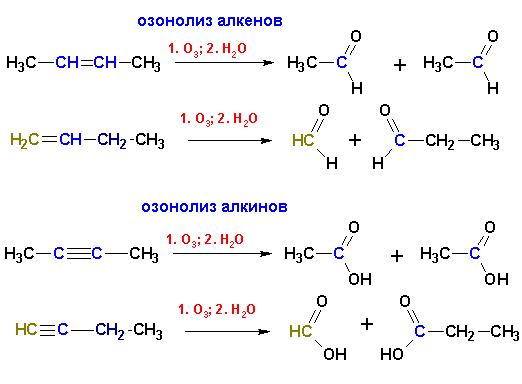
Озонирование с последующей обработкой продуктов (озонидов) водой приводит к образованию альдегидов и кетонов (в случае алкенов) или карбоновых кислот (алкины):
Отличительные реакции алкинов.
Вследствие того, что sp-гибридизованный углерод алкинов является более электроотрицательным, водород при атоме углерода с тройной связью обладает значительно более кислыми свойствами, чем водород при sp2-гибридизованном углероде в алкенах и еще значительней- чем водород при sp3-гибридизованном углероде алканов. В связи с этим для алкинов с концевой тройной связью характерны реакции замещения водорода:
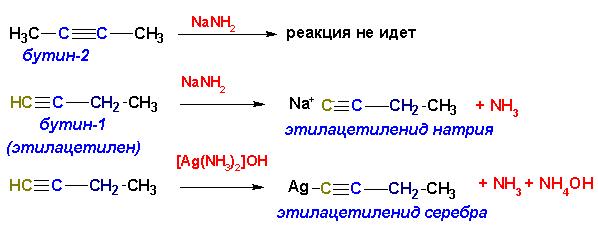
Если замещение на атомы щелочных металлов происходит только при действии очень сильных оснований (NaNH2, NaH, бутил-натрий и т.п.), то замещение тяжелыми металлами (Cu, Ag, Hg) протекает очень легко, в водных растворах при комнатной температуре. Ацетилениды тяжелых металлов в сухом состоянии неустойчивы и разлагаются со взрывом.
Получение алкенов.
В промышленности важным источником непредельных соединений являются продукты крекинга и пиролиза нефтяных фракций, а также газы коксования (этилен, пропилен).
С той же целю часто применяются способы дегидрогенизации алканов на катализаторах:
СН3-СН2-СН2-СН3 --> СН2=СН-СН2-СН3 + СН3-СН=СН-СН3 + Н2
Катализатором этого процесса обычно является специальным образом приготовленная окись хрома Cr2O3 при 300 оС.
1. Обычным способом получения алкенов в лабораторных условиях является дегидратация спиртов:
СН3-СН2-СН2-ОН --> СН3-СН=СН2 + H2O
Катализаторами дегидратации служат минеральные кислоты. Процесс дегидратации протекает по следующему механизму:
На этапе отщепления молекулы воды образуется карбкатион. Образовавшийся карбкатион очень часто претерпевает изомеризацию (в результате гидридного или алкильного сдвига), при этом может даже измениться углеродный скелет молекулы.
Карбкатион отщепляет протон и превращается в алкен. Обычно существует два возможных варианта отщепления протона (от одного из соседних с заряженным атомом углерода положений), поэтому получается два разных продукта. В качестве основного продукта образуется наиболее устойчивый алкен (правило Зайцева). Наиболее устойчивыми являются транс-изомеры максимально замещенных алкенов, с минимальными стерическими затруднениями, создаваемыми соседними группировками.
2. Алкены получают дегидрогалогенированием (отщеплением галогеноводорода) галоидных алкилов:
СН3-СНCl-СН2-СН3 --> СН2=СН-СН2-СН3 + СН3-СН=СН-СН3 + HCl
Отщепление галогеноводорода осуществляется спиртовым раствором щелочи (KOH, NaOH) при нагревании и протекает также с образованием наиболее устойчивого алкена (правило Зайцева). Так, основным продуктом вышеприведенной реакции будет транс-бутен-2. Механизм отщепления галогеноводорода зависит от ряда факторов, и нами здесь не рассматривается.
3. Метод ДЕГАЛОГЕНИРОВАНИЯ вицинальных (“рядом стоящих”) дигалогеналкилов является способом получения чистых алкенов. Полученных продукт содержит кратную связь в том месте, где находились галогены:
СН2Cl-СНCl-СН2-СН3 + Zn --> СН2=СН-СН2-СН3 + ZnCl2
4. В редких случаях алкены получают гидрированием более доступных алкинов:
СН3-С≡С-СН3 + Н2 --> СН3-СН=СН-СН3.
Методы получения алкинов
1. Наиболее часто алкины получают дегидрогалогенированием дигалоидных алканов (вицинальных или геминальных):
СН2Cl-СНCl-СН2-СН3 --> СН≡С-CH2-СН3 + 2HCl
Как и в случае алкенов, реакцию ведут в спиртовых растворах щелочей. Вначале отщепляется одна молекула галогеноводорода. Образующийся галоидзамещенный алкен отщепляет вторую молекулу галогеноводорода с гораздо бОльшим трудом, чем первую. Для получения алкинов отщепление второй молекулы галогеноводорода требует применения твердой щелочи при нагревании или более сильного основания, такого, как амид натрия NaNH2.
2. Алкилированием ацетилена могут быть получены многие другие алкины (гомологи ацетилена). Реакция проводится в две стадии. Вначале получают ацетиленид щелочного металла:
НС≡СН + NaNH2 (или СH3-Mg-J) --> НС≡СNa + NH3 (или НС≡С-Mg-J + СH4)
Полученные металлорганические производные ацетилена алкилируют галоидными алкилами:
НС≡СNa (или НС≡С-Mg-J) + СН3-J --> HC≡C-CH3 + NaJ (MgJ2)
Операции можно повторить и заместить таким образом второй атом водорода у ацетилена, но обычно получить в чистом виде моноалкилацетилены невозможно, так как получается смесь моно- и дизамещенных ацетиленов.
© khassanov, MMII-MMXV |