
ГОУ ВПО томский государственный университет |
кафедра органической химии |
Фенолы |
Термин фенолы происходит от
старинного названия бензола «Фен»,
введенного Лораном в
Сам фенол- бесцветное легкоплавкое кристаллическое вещество, с характерным запахом, быстро розовеющее на воздухе вследствие окисления. Немного растворяется в воде (8% при 15 оС), вода растворяется в феноле с образованием жидких растворов.
Фенол растворяется в щелочах с образованием фенолятов. Однако, уже СО2 способна выделять фенол из растворов фенолятов. Фенол- слабая кислота, гораздо слабее уксусной кислоты, но на несколько порядков кислее воды, не говоря уже об алифатических спиртах. Кислотные свойства фенолов выражены гораздо ярче, чем у спиртов, благодаря описанной ниже делокализации отрицательного заряда от кислорода в кольцо, что стабилизирует анион фенолята, тем самым, облегчая отщепление протона и проявление кислотных свойств:

Алифатические спирты на такую делокализацию неспособны. Более того, в отличие от воды они являются более слабыми кислотами, поскольку алкоголят-анион у них дестабилизирован положительным индуктивным (электронодонорным) эффектом алкильных групп:
![]()
Таблица кислотных свойств фенола и его производных
|
рКа |
|
рКа |
фенол |
10,0 |
О-метокси |
9,98 |
П-нитро |
7,15 |
М-метокси |
9,65 |
2,4-динитро |
4,07 |
П-метокси |
10,21 |
2,4,6-тринитро |
0,42 |
|
|
циклогексанол |
18,0 |
|
|
1. Номенклатура
Если ароматическое кольцо содержит одну гидроксильную группу, то это одноатомные фенолы:

При наличии двух и более гидроксильных групп фенолы называют, соответственно, двух-, трехатомными и т.д.

При наименовании фенолов широко применяется тривиальная номенклатура.
2. Химические свойства фенолов
Реакции гидроксила фенолов
1. Образование фенолятов

2. Образование простых эфиров фенолов взаимодействием фенолятов с галоидными алкилами или диметилсульфатом (СН3-О-SO2-O-CH3)

3. Образование сложных эфиров фенолов
Не может быть проведено взаимодействием с кислотами, проводят реакцией фенолятов (в щелочной среде) с галогенангидридами или ангидридами кислот:

4. Реакция фенола с галоидами фосфора вместо замещения гидроксила на галоген приводит к образованию эфиров фосфористой (если реагирует с PCl3) или фосфорной (если реагирует с PCl5) кислот:

(трифенилфосфит)
5. При перегонке с цинковой пылью фенолы превращаются в углеводороды (бензол).
3. Реакции ароматического ядра фенолов
1. Галоидирование фенолов
Гидроксил- один из сильнейших, а в щелочной среде- сильнейший орто- пара- ориентант, поэтому реакции электрофильного замещения для фенолов легко протекают с элементарными галогенами (включая иод) и при этом образуются тризамещенные производные (особенно в водной среде).
Бромирование фенола избытком бромной воды проходит по схеме:
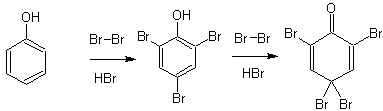
2. Сульфирование фенолов
 |
Мононитропроизводные фенолов получают нитрованием разбавленной азотной кислотой на холоду.
2,4-динитрофенол проще получить гидролизом 2,4-динитрохлорбензола.
Тринитрофенол (пикриновую кислоту) получают в промышленном масштабе, нитруя крепким нитрующим раствором, 2,4-фенолдисульфокислоту, получаемую сульфированием фенола (не выделяя ее из реакционной массы). Наличие сульфогрупп, удаляемых по мере протекания нитрования, защищает фенол от окисления азотной кислотой:
 |
Если нитровать в присутствии соли ртути бензол, то образующийся м- динитробензол окисляется до 2,4-динитрофенола, который нитруется далее.
Свойства нитрофенолов
Нитрофенолы- гораздо более сильные кислоты, особенно, если нитрогруппа находится в орто- или пара- положениях к гидроксилу (и, тем более, если она не одна). Орто- нитрофенол довольно резко отличается от своего пара- изомера и от самого фенола тем, что он не ассоциирован в углеводородных растворах. Фенол, как и все гидроксильные соединения, ассоциирован за счет образования водородных связей между гидроксилами, а п-нитрофенол еще и за счет Н-связей между нитрогруппой одной молекулы и гидроксилом другой. В орто-нитрофеноле водородная связь осуществляется внутри молекулы, поэтому гидроксил уже не способен к образованию гидроксильных связей на стороне. Такое строение обуславливает более низкую температуру плавления, бОльшую растворимость и способность перегоняться с водяным паром (молекулы не связаны друг с другом, а также окраску).
5. Реакция Кольбе (фенол с СО2 салициловая кислота)
При нагревании (120 оС) фенолята натрия в токе СО2 (под давлением 5 атм) образуется салицилат натрия (реакция Кольбе). При действии на фенолят четыреххлористого углерода CCl4 также образуется салицилат натрия, а при действии хлороформа- салициловый альдегид (реакция Реймера- Тимана):
 |
6. Реакция Реймера-Тимана
(фенол + CHCl3, CCl4)
На предварительном этапе образуется электронодефицитный дихлоркарбен :CCl2 (секстет электронов на внешнем уровне):
(HO – + H–CCl3--> HOH + CCl3– --> :CCl2 + Cl –)
который далее реагирует с электроноизбыточным кольцом фенола, атакуя мягкий нуклеофильный центр по атому углерода:
 |
Образующееся дихлорпроизводное легко гидролизуется в щелочной среде до альдегидной группировки (салициловый альдегид).
7. Конденсация фенолов с формальдегидом. Фенолоформальдегидные смолы
(А. Байер,
Наибольший интерес представляет собой конденсация фенола с формальдегидом, бурно протекающая в присутствии серной кислоты с образованием вначале линейного полимера, называемого «новолак»:

Если взять формальдегид в избытке и проводить конденсацию в щелочной среде,
сначала образуется легкоплавкий и сравнительно низкомолекулярный полимер- резол. Это т.н. термореактивный полимер: при
нагревании протекает дальнейшая конденсация свободных оксиметиленовых групп с образованием метиленовых мостов и полимер
приобретает сетчатую структуру. Получаемый резитол нерастворим в органических растворителях, но сохраняет некоторую пластичность.
При нагревании до 150 оС полимеризация идет дальше и получается неплавкий и нерастворимый полимер- резит.
Резол (или Бакелит А)- стекловидная масса, осаждающаяся после проведения конденсации фенола с формальдегидом в щелочной среде при 80 оС (соотношение 1:1). Смола растворяется в ацетоне.
При непродолжительном нагревании при 150 оС твердеет окончательно, превращаясь в резит (Бакелит С), обугливающийся без плавления при 300 оС.
Резитол- промежуточное состояние (Бакелит В)- растворяется плохо, но еще пластичен.
На основе фенолоформальдегидных полимеров могут быть получены наполненные пластики, обладающие высокой прочностью и устойчивостью к истиранию. Например, на основе пропитанной полимером бумаги штампуются отличные зубчатые колеса и шестеренки.
8. Окисление фенолов
Фенол и его гомологи (в
особенности- содержащие электронодонорные группировки) легко отдают гидрид-ион (окисляются) до хинонов и семихинонов:

4. Способы получения фенолов
1. Самый старый способ- щелочное плавление бензолсульфокислоты:

2. Некоторое количество фенола получают по способу Рашига, гидролизом хлорбензола парами воды над промотированным Cu2+ силикагелем при 450-500 оС:

3. Окисление изопропилбензола (кумола) кислородом воздуха:

Имеет ценное практические применение, поскольку в одну стадию получаются два ценных продукта. Изопропилбензол получается алкилированием бензола. Реакция окисления имеет радикальный характер и протекает с промежуточным образованием перекиси и перегруппировкой (сдвигом бензольного кольца).
4. Введение гидроксила на место аминогруппы (диазотирование) не применяется для самого фенола, но таким способом получают другие производные.

© khassanov, @MMII-MMXIV |