1) E + S ----- ES (K = k1/k-1) (БЫСТРАЯ)
2) ES ----- EP (k2)(медленная)
3) EP ---- E + P
Таким образом, в момент равновесия скорости образования и исчезновения энзимсубстратного комплекса (ES) равны:
E + S ---- ES ----- EP --- E + P
МЕХАНИЗМ ФЕРМЕНТАТИВНОГО КАТАЛИЗА
Катализ приводит к ускорению достижения равновесия за счет снижения энергии активации (Еа), часто ступенчато.
| Три стадии процесса: 1) E + S ----- ES (K = k1/k-1) (БЫСТРАЯ) 2) ES ----- EP (k2)(медленная) 3) EP ---- E + P Таким образом, в момент равновесия скорости образования и исчезновения энзимсубстратного комплекса (ES) равны: E + S ---- ES ----- EP --- E + P |
ВЛИЯНИЕ НА НАЧАЛЬНУЮ СКОРОСТЬ РЕАКЦИИ КОНЦЕНТРАЦИЙ ФЕРМЕНТА [E] и СУБСТРАТА [S].
| [E]- ЗАВ-ТЬ ЛИНЕЙНАЯ,
[S]- ЗАВ-ТЬ ГИПЕРБОЛИЧЕСКАЯ. (Это значит, что при малых S- порядок первый, далее переходит в нулевой). Пунктиром на графике зависимости скорости от концентрации фермента показано влияние ферментных ядов (ингибиторов), проявляющееся в медленном нарастании скорости реакции до момента, пока не будет преодолено влияние яда повышением количества энзима. |
УРАВНЕНИЕ МИХАЭЛИСА - МЕНТЕН
При формулировке кинетического выражения для скорости ферментативной
реакции Бриггс и Холдейн (Briggs & Haldane, 1925) сделали три допущения:
1) Стационарное состояние реакции в момент равновесия, когда скорости образования
и расходования ES равны;
2) Весь фермент в условиях насыщающих концентраций субстрата превращается в
энзимсубстратный комплекс ES;
3) Если весь фермент в виде ES, то скорость реакции максимальна и Vmax=k2[ES].
Образование ES: [ES]=k1[S][E] (I)
Расходование ES: [ES]=k-1[ES]+k2[ES] (II)
Приравнивая выражения (I) и (II) и сокращая обе части на k1 получаем:
[S][E] = [ES](k-1 + k2)/k1 = [ES]Km,
где Km = (k-1 + k2)/k1
Выразим равновесную концентрацию [E] через начальную [Eo]: [E] = [Eo] - [ES]
[S]([Eo]-[ES])= [ES]Km, переносим [S] в правую часть выражения и делим обе части
на [ES]:
[Eo]/[ES]=Km/[S]+1= (Km+[S])/[S] (III)
Поскольку трудно (если не невозможно) измерить [ES], произведем замену с учетом
того, что в насыщающих концентрациях [S] весь [Eo] перейдет в [ES] и максимальная
скорость при этом будет равна Vmax=k2[ES]=k2[Eo].
В это же время скорость реакции равна V=k2[ES]. Через отношение
этих скоростей выразим [Eo]/[ES]:
V/Vmax= [ES]/[Eo]
В уравнении (III) произведем замену отношения [Eo]/[ES] на Vmax/V и получаем:
V = Vmax[S]/(Km+[S])
Это и есть уравнение Михаэлиса-Ментен. Название было закреплено за ними, несмотря на то,
что Леонор Михаэлис
и Мод Ментен только постулировали
положение о том, что фермент обратимо связывается с субстратом (1913). Основу ферментативной кинетики положил
Виктор Генри в 1903 году, впервые предположивший зависимость между концентрациями субстрата и фермента в ферментативных реакциях.
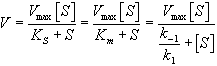
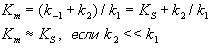
Графическая зависимость для уравнения имеет вид:
| Константа Михаэлиса измеряется в молях на литр и бывает от 10-2 до 10-7, чем меньше Кm, тем активнее фермент. При V=1/2Vmax, имеем Km = [S]. Однако, определение Vmax затруднительно по асимптоте. Для устранения этого неудобства ХАНС ЛАЙНУИВЕР и ДИН БЭРК приравняли обратные зависимости левой и правой частей уравнения. |
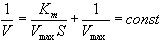
Графическое выражение для скорости реакции в координатах Лайнуивера-Бэрка имеет вид прямой линии, отсекающей на оси Х значение -1/Km, а на оси Y- значение 1/V max:
ВЛИЯНИЕ ТЕМПЕРАТУРЫ И рН НА АКТИВНОСТЬ ФЕРМЕНТА
В общем, для ферментов имеется связь константы скорости и температуры, выражаемая: 2,3 lgK = B- Ea/RT, где Еа- энергия активации, В-частота столкновений.
Однако, указанная зависимость прямолинейна лишь на ограниченном отрезке, так как с ростом температуры наблюдается денатурация фермента.
Зависимость активности фермента от рН также проходит через максимум. Кислотность среды влияет на заряды в молекуле фермента и, тем самым, на его способность к связыванию субстрата.
Единицы
активности:
Е (станд. ед) - количество Ф., которое превращает 1 мкМоль субстрата за 1 мин.
КАТАЛ- кол-во Ф., превращающее субстрат со скоростью 1 Моль/сек.
1 КАТАЛ = 60 000 000 Е.
ИНГИБИТОРЫ ФЕРМЕНТОВ
Наверх
1) ОБРАТИМЫЕ
2) НЕОБРАТИМЫЕ (КАК ПРАВИЛО- НЕПРИРОДНОГО ПРОИСХОЖДЕНИЯ - NaF (ингибитор фосфатаз), п-хлормеркурибензоат (связывает группировки -SH), диизопропилфторфосфат (протеиназ и эстераз)- эти ингибиторы действуют необратимо.
ОБРАТИМЫЕ ИНГИБИТОРЫ- клеточные метаболиты и типы ингибирования
а) КОНКУРЕНТНОЕ ингибирование
б) НЕКОНКУРЕНТНОЕ ингибирование
в) БЕСКОНКУРЕНТНОЕ ингибирование
а) КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ- когда за активный центр фермента
вместе с субстратом конкурирует ИНГИБИТОР:
Е + I = EI Ki = [E][I] / [EI], чем меньше Ki, тем
сильнее ингибитор.
| Так, малоновая (1), щавелевоуксусная (2) и глутаровая (3) кислоты ингибируют фермент СУКЦИНАТДЕГИДРОГЕНАЗУ, субстратом которой является янтарная кислота (4) (СУКЦИНАТ), так как они сходны по строению с субстратом: |
| Другой пример. Сульфаниламидные антибактериальные препараты имеют сходное строение с парааминобензойной кислотой и являются конкурентными ингибиторами в синтезе бактериями фолиевой кислоты (фактора роста бактерий). У человека нет такого метаболического пути и в лечебных дозах они не влияют на жизнедеятельность человека, оказывая общий БАКТЕРИОСТАТИЧЕСКИЙ эффект (нарушая в некоторой степени деятельность кишечной микрофлоры): |
2) НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ ПРОЯВЛЯЕТСЯ ПРИ СВЯЗЫВАНИИ ИНГИБИТОРА С ФЕРМЕНТОМ ВНЕ АКТИВНОГО ЦЕНТРА, но при этом меняется структура активного центра и связь с субстратом становится невозможной.
E + I ---> EI, EI + S ----> (невозможно)
3) БЕСКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ - результат присоединения
ингибитора ТОЛЬКО ПОСЛЕ образования ЭНЗИМСУБСТРАТНОГО КОМПЛЕКСА:
E + S = ES ES + I = ESI
ОПРЕДЕЛЕНИЕ ТИПА ИНГИБИРОВАНИЯ
1) КОНКУРЕНТНЫЙ ИНГИБИТОР увеличивает Кm и не изменяет V max.
2) НЕКОНКУРЕНТНЫЙ ингибитор не изменяет Кm и снижает V max.
3) БЕСКОНКУРЕНТНЫЙ ингибитор в одинаковой степени снижает Кm и V max:
Некоторые продукты ферментативных реакций также выступают в
роли ингибиторов. Так, глюкоза ингибирует фермент Г-6-фосфатазу:
Глюкозо-6-фосфат + Н2О -- Глюкоза + Н3РО4
Ингибирование избытком субстрата наблюдается в ряде случаев в результате блокирования активного центра по схеме:
АКТИВАТОРЫ ФЕРМЕНТОВ
1) ПУТЕМ ЗАЩИТЫ Ф. ОТ ИНАКТИВИР. ВЛИЯНИЙ
2) ПУТЕМ ВОЗДЕЙСТВИЯ НА СУБЪЕДИНИЦЫ БЕЛКОВ Ф.
Ферменты-протеинкиназы имеют 4-ную структуру, состоят их 2-х субъед- каталитической и регуляторной. Активатор воздействует на регуляторную, а в результате обнажается каталитическая субъединица:
АЛЛОСТЕРИЧЕСКИЕ ЭФФЕКТОРЫ
Аллостерическими
эффекторами называют ингибиторы (отрицательные эффекторы) и активаторы (положительные
эффекторы) энзимов, регулирующие активность ферментов в широких пределах, не
затрагивая при этом активного центра, поскольку воздействуют на него опосредованно,
присоединясь к молекуле фермента ВНЕ активного центра. Они способны управлять
конформацией активного центра таким образом, что присоединение субстрата либо
облегчается значительно, либо вовсе становится невозможным:
1) Структура аллостерических
эффекторов отлична от природного субстрата фермента.
2) Высокоспецифичны
3) Катализируют фермент первой цепи процесса.
Среди аллостерических эффекторов различают эффекторы V-типа, которые подобно неконкурентным ингибиторам (см. выше) изменяют значение Vmax:
КООПЕРАТИВНЫЙ ЭФФЕКТ
Характерен для ферментов, имеющих 2 и более субъединиц. Присоединение субстрата
или эффектора к одной из субъединиц облегчает последующие присоединения к оставшимся
субъединицам. Типичный пример кооперативного эффекта- перенос кислорода молекулами
гемоглобина.
ПРОФЕРМЕНТЫ
Неактивная форма Ф. Активация осуществляется удалением части полипептидной цепи,
обнажению активного центра, при помощи специфических ферментов. Биологический
смысл- в месте продукции Ф. мог бы вызвать нежелательные последствия (переваривание
и т.д.).
ИЗОФЕРМЕНТЫ
отличные по структуре, но выполняющие одну и ту же функцию. Изоферментами, в
частности, существуют алкогольдегидрогеназа и целых 5 изомеров лактатдегидрогеназы.
Изоферменты могут различаться по каталитической активности, несмотря на то,
что катализируют одну и ту же реакцию. Так, в клетках печени человека различаются
цитоплазматическая ацетальдегиддегидрогеназа (низкоактивная, с высоким значением
Km) и митохондриальная ацетальдегиддегидрогеназа (AcDH), с малым значением Km.
Последнее обстоятельство является биохимической причиной непереносимости алкоголя
у коренного населения Юго-Восточной Азии, которое связано с практическим отсутствием
у них (по генетическим причинам) митохондриальной AcDH и превращение образовавшегося
из этанола ацетальдегида осуществляется у них малоактивной цитоплазматической
AcDH.
ПРИМЕНЕНИЕ
ФЕРМЕНТОВ В ДИАГНОСТИКЕ И ДРУГИХ ОБЛАСТЯХ
Ферментные препараты
и регуляторы их активности находят все более широкое применение в различных
областях медицины, промышленности и науки.
В медицине используются энизимы, как терапевтические средства:
- СТРЕПТОКИНАЗА- смесь энзимов из семейства Streptococcus, активизирующих
ПЛАЗМИНОГЕН и образование ПЛАЗМИНА, приводящее к растворению ФИБРОЗНЫХ ТРОМБОВ
в кровеносных сосудах. Рекомбинантный тканевый активатор плазминогена rh-tPA
производится генно-инженерным способом на E.Coli и вводится человеку.
- АСПАРАГИНАЗА используется в терапии ЛЕЙКЕМИИ взрослых. Опухолевые клетки нуждаются
в АСПАРАГИНЕ, который они извлекают из плазмы крови. Внутривенное введение (i.v.)
аспарагиназы снижает содержание аспарагина и замедляет рост раковых клеток.
К сожалению, достижение высоких терапевтических доз таким способом невозможно.
ЭНЗИМЫ, КАК ДИАГНОСТИЧЕСКИЕ ПОКАЗАТЕЛИ
Измерением энзиматической активности в образцах крови можно осуществлять диагностику ряда патологий. Так, повреждение сердечной мышцы (инфаркт миокарда) диагностируется повышенной активностью изоэнзимов КРЕАТИНФОСФОКИНАЗЫ 2 и 3 (СРК-2 и 3) и соотношению активностей ферментов ЛАКТАТДЕГИДРОГЕНАЗЫ 1 и 2 (LDH1/LDH2) методами иммуноферментного анализа (ИФА) или электрофореза. Активность указанных изоферментов СРК повышается после момента острой грудной боли, достигая максимума на 1-е сутки (СРК-3) и 2-е сутки (СРК-2), а соотношение активностей LDH1/2 от 0,75 (в норме) изменяется до 1,25 (инфаркт миокарда). В последнее время широко распространяется тест на тропонин, который измеряет измеряет уровень белков тропонинов Т или I в крови. Эти белки высвобождаются при повреждении сердечной мышцы в результате гликолиза при кислородном голодании (инфаркт миокарда), сердечном приступе. Чем обширнее была область инфаркта, тем большее количество тропонинов Т и I окажется в крови. |
В терапевтических
целях широко используются ингибиторы ферментов. Так, блокадой АЦЕТАЛЬДЕГИДДЕГИДРОГЕНАЗЫ
в стационарных условиях осуществляется терапия хронического алкоголизма. Широкое
распространение получили антибактериальные сульфаниламидные препараты на основе
СУЛЬФАМЕТОКСАЗОЛА (входящие в состав препарата БИСЕПТОЛ и его аналогов), блокирующие
синтез у бактерий фолиевой кислоты.
В промышленности широко применяются иммобилизованные ферменты. С их помощью
синтезируются лекарственные препараты (например, ПРЕДНИЗОЛОН) из дешевых предшественников
(ХОЛЕСТЕРИН), с высокой стереоспецифичностью, быстро и качественно. Таким же
способом, с иммобилизованной бета-ГАЛАКТОЗИДАЗОЙ цельное молоко очищается от ЛАКТОЗЫ, после чего оно становится возможным для употребления чувствительными
к галактозе лицами.
Существует еще огромное число примеров использования ферментов, возрастающее
с каждым годом.
НОМЕНКЛАТУРА
И КЛАССИФИКАЦИЯ ЭНЗИМОВ
ВЕРНУТЬСЯ
НА НАЧАЛЬНУЮ СТРАНИЦУ