|
томский государственный университет |
|
кафедра органической химии |
|
ОПРЕДЕЛЕНИЕ
ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКА |
Определение первичной структуры белка требут предварительного проведения ряда операций. Белок
должен быть тщательно очищен, чистота материала должна быть подтверждена как
минимум двумя независимыми методами. Чаще всего использется
гель-электрофорез на полиакриламиде (ПААГ) и ультрацентрифугирование. После очистки белка его делят на
две-три или более частей. Каждую часть обрабатывают разными ферментами- протеиназами (трипсин,
химотрипсин) или реагентами (бромциан, иодозобензойная
кислота). В результате получают два-три (или более) наборов полипептидов
(отрезков белка). К ферментам-протеиназам
предъявляются особые требования по чистоте, иначе будет затруднено последующее
определение последовательности чередования отрезков пептидов в нативной цепи белка. Особые сложности представляет
распознавание мест дисульфидных мостиков между
остатками цистеина. Полученная смесь пептидов разделяется электрофорезом, после
чего возможно начать непосредственно процедуру севенирования.
Длина отдельного пептида не должна превышать 40 АК-остатков.
Наиболее часто используемым методом секвенирования
пептидов (установления последовательности АК-остатков в них) является процедура
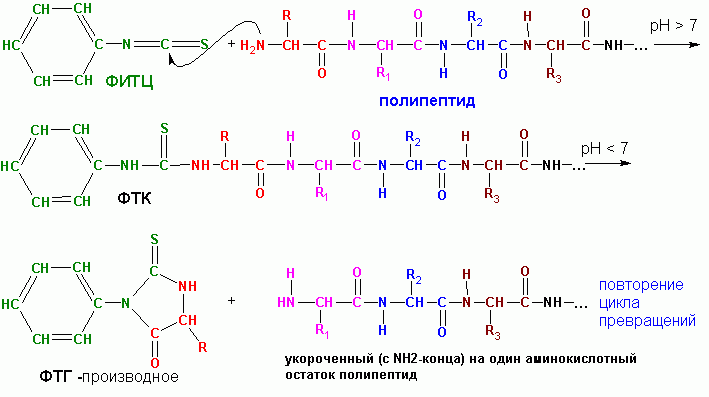
П. Эдмана , с использованием
фенилизотиоцианата (ФИТЦ). Процедура лежит в основе
работы автоматических секвенаторов.
Образец очищенного пептида наносится на поверхность реакционного сосуда в виде
пленки. Часто осуществляют ковалентное пришивание пептида с конца свободной
СООН-группы с материалом поверхности реакционного сосуда. После чего проводят
повторяющиеся циклы из серии реакций. Одна серия реакций включает:
- взаимодействие ФИТЦ с концевым АК-остатком, имеющим свободную NH2-группу,
при этом образуется так называемое ФТК-(фенилтиокарбамоил)-производное:
- избыток ФИТЦ удаляется, меняется рН среды добавлением гептафтормасляной
кислоты, при этом происходит превращение ФТК в ФТГ (фенилтиогидантоин)-производное:
- ФТГ-производное аминокислоты удаляется из реакционной среды экстракцией с 1-хлорбутаном и серия реакций повторяется в следующем цикле.
За один цикл удаляется один аминокислотный остаток с NH2-края пептида. Поскольку,
реакции с ФИТЦ протекают не количественно, а в лучшем случае, на 95 процентов,
постепенно накапливаются мешающие факторы-
ФТГ-производные от не прореагировавших в предыдущие циклы АК-остатков. В самых
благоприятных случаях удается надежно идентифицировать последовательность всего
только около 40 АК-остатков. Однако, благодаря автоматизации процесса, работа
все же существенно облегчается.
РАСШИФРОВКА ПРИ ПОМОЩИ ПЕПТИДАЗ:
а) с N-концевых остатков при помощи АМИНОПЕПТИДАЗ (хроматографическая идентификация и кинетика накопления соответствующих АК.
б) с С-концов при помощи карбоксипептидаз (аналогично).
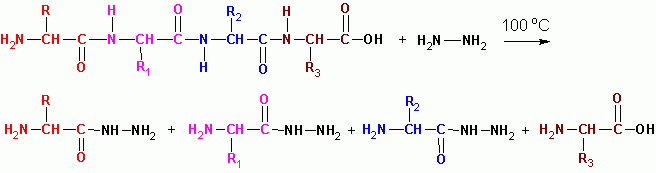
ГИДРАЗИНОЛИЗ (в безводной среде при 100 град С) за исключением последнего остатка со свободной СООН, все превращаются в гидразиды кислот:
Порядок чередования пептидов в молекулах белков определяется по перекрыванию фрагментов пептидов:
G-W-V-R A-O-V-K C-E-C-D триптические пептиды (трипсин)
G-W V-R-A-O V-K-C-E-C-D химотриптические пептиды (химотрипсин)
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА:
1. Строев Е.А. Биологическая химия. М., 1986.
2. Страйер Л. Биохимия, в 3-х т. М., Мир, 1984.
3. Уайт, Хендлер, Смит и др. Основы биохимии, в 3-х
т. М., Мир, 1981.
4. Овчинников Ю.А. Биоорганическая химия, М., Просвещение, 1987.
5. Анисимов и др. Основы биохимии. М., Высшая школа, 1986.
ВЕРНУТЬСЯ К СТРАНИЦЕ ПРОТЕИНЫ
ВЕРНУТЬСЯ К НАЧАЛЬНОЙ СТРАНИЦЕ
|
©khassanov,
MMII-MMXII
|