|
|
|
ОРГАНИЧЕСКАЯ ХИМИЯ в томском государственном университете |
Методы очистки и выделения белков. Часть 3.
Электрофоретические
методы разделения протеинов
Электрофорез на полиакриламидном геле (ПААГ, PAGE).
Суть метода- разделение заряженных соединений на основе их подвижности в электрофоретическом поле. При наложении разности потенциалов в какой-то среде положительно заряженные молекулы движутся к отрицательно заряженному электроду, а отрицательно заряженные- к положительному электроду. В качестве среды разделения используется гель полиакриламида в воде. Если в горячей воде растворить определенное количество полиакриламида и затем раствор охладить образуется студень, называемый гелем. Природа любого геля- структура, в которой молекулы воды удерживаются внутри трехмерной сетки, образованной длинными полимерными молекулами. С увеличением концентрации молекул полимера в геле "ячейки" этой сетки становятся все мельче, а с уменьшением- наоборот, диаметр "ячейки" увеличивается. В основу разделения молекул белков гель-электрофорезом положены эти основные характеристики геля.
Наиболее часто разделение осуществляется на пластинах, покрытых слоем геля толщиной 2-3 мм. Размеры пластины 10 х 14 см или иное, в зависимости от конструкции прибора. В процессе электрофореза пластина с гелем разогревается в результате протекания через нее тока. Степень разогрева пластины зависит от величины напряжения, при котором происходит разделение. Чем выше напряжение, тем выше сила протекающего по пластине тока и сильнее ее разогревание, поэтому применение высоких напряжений должно сопровождаться охлаждением пластины, чтобы не допускать тепловую денатурацию разделяемых белков. Величина продвижения белков в геле зависит (в идеале) только от величины наложенного потенциала и времени. В среднем, основная масса разделений требует около 2000 В.часов. Это означает, что при потенциале 500 В разделение может закончиться за 4 часа, а при потенциале 150 В на это потребуется около 14 часов.
Аппаратура для гель-электрофореза может различаться конструктивно при неизменности принципов разделения.
Существуют две основные разновидности электрофореза – на градиентных гелях и с ионным детергентом (ДСН-ПААГ, SDS-PAGE).
Электрофорез на градиентном полиакриламидном геле.
В качестве среды разделения используется пластина с гелем с изменяющейся концентрацией (от 4 до 30 %) полиакриламида. Чаще всего используются ТРИС-боратные буферы (рН=8,4) с добавками динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА). Гель уравновешивается с буфером наложением потенциала 70 В в течение 20 мин (без добавления образца). После этого наносятся полосы анализируемых образцов и маркеров (белков с известной ММ) и накладывается потенциал 150 В, разделение продолжается 16 часов. (Или 3 часа при 500 В- если имеется возможность охлаждения пластины).
Фиксирование полос происходит 30 мин в 10 % растворе сульфосалициловой кислоты, после чего пластина окрашивается красителем Кумасси Голубой (0,02% в 7% уксусной кислоте) в течение ночи. Пластина осветляется электрофорезом при 24 В 45 мин в 7% уксусной кислоте, после чего можно наблюдать окрашенные полосы белков.
Разделение осуществляется в результате задерживания (застревания) белковых молекул во все более мелкопористом (рост содержания полиакриламида) геле. При этом происходит накопление белка, за счет постепенного «подтягивания» отстающих молекул. Метод отличается высокой эффективностью разделения и очень узкими полосами разделения. Количество наносимой пробы зависит от способа окрашивания белка, с красителем Кумасси составляет 5 мкл. (С серебряным прокрашиванием- концентрация белка может быть в 50 раз меньше).
Электрофоретическая картина разделения на
градиентном геле коммерческих протеинов (апоферритин- полоса 2, гексокиназа- 3
и инвертаза - 4) с белками-маркерами молекулярной массы (полосы 1 и 5) показана
ниже:
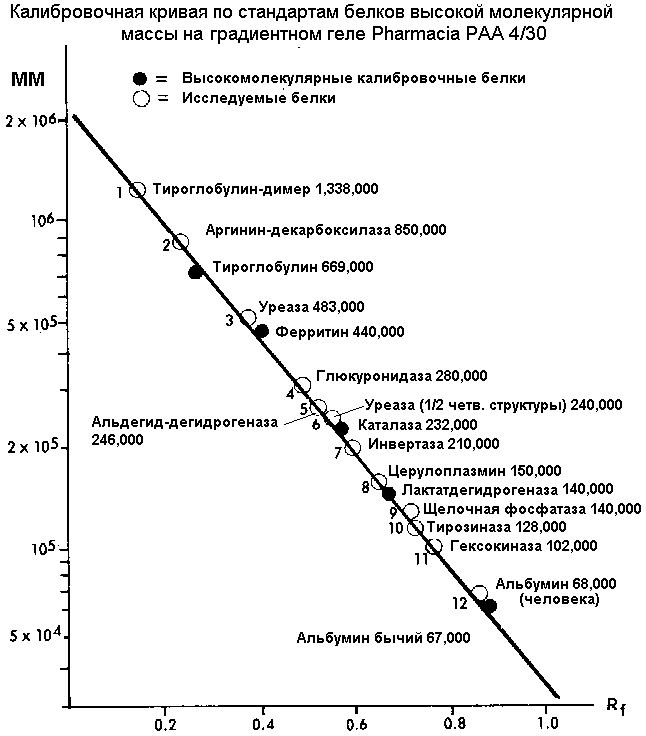
Калибровочный график для определения молекулярных масс неизвестных белков
представляет собой зависимость:
Электрофорез SDS-PAGE (с додецилсульфонатом натрия).
Наиболее распространенным в последнее время является вариант электрофореза в присутствии детергентов, в частности- додецилсульфоната натрия (SDS). Процесс можно осуществлять как на геле постоянной плотности, так и на градиентных гелях. В основе метода лежит способность детергента реагировать и денатурировать широкий спектр белков одинаковым образом. Нативные белки, имеющие различные форму молекулы, заряд и размеры в процессе взаимодействия с SDS превращаются в комплексы с ним, имеющие постоянное соотношение заряда на единицу массы (так как заряд SDS маскирует заряды протеинов) и идентичную конформацию, которая варьирует в размере прямо пропорционально молекулярной массе субъединицы. При неизменных условиях электрофореза (рН, напряжение, время, концентрация геля и т.д.) электрофоретическая подвижность протеина зависит от его плотности заряда, массы и формы. Поскольку большинство комплексов протеин-SDS имеют постоянные соотношения "заряд-масса" и идентичную форму, их подвижность зависит исключительно от размера. Поэтому определение молекулярной массы неизвестного протеина сводится к сравнению подвижности его комплекса с SDS с подвижностью комплексов "SDS-протеин известной молекулярной массы". Обработка образцов осуществляется добавлением SDS до концентрации 2,5% и бетта-меркаптоэтанола до концентрации 5%, после чего смесь тщательно перемешивается и нагревается при 100 С (в кипящей водяной бане) в течение 5-10 минут. Таким образом достигается полная денатурация и диссоциация четвертичной структуры.
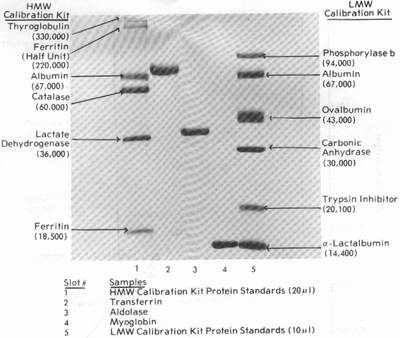
Электрофоретическая картина разделения протеинов
на геле постоянной концентрации (12,6%) в присутствии детергента (0,1% SDS)
выглядит так:
И ее калибровочная зависимость:
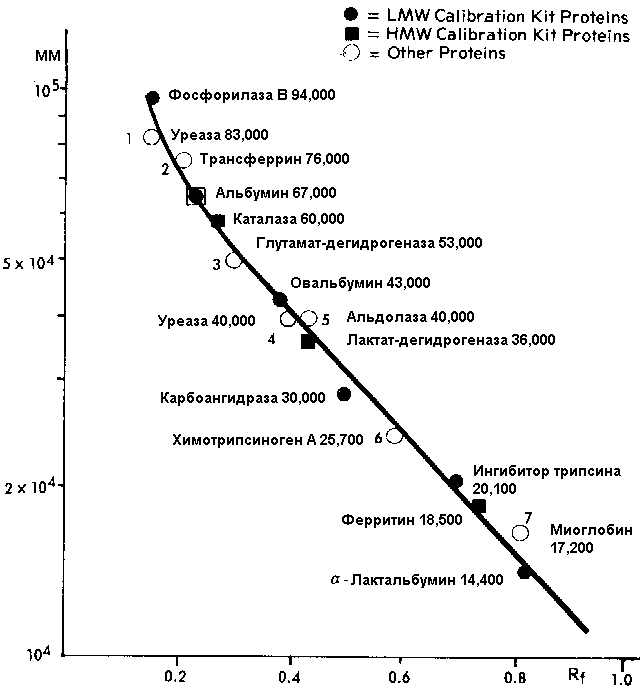
То же разделение, на градиентном геле Pharmacia PAA 4/30 в 0,2% SDS:
и его графическая зависимость для определения молекулярной массы:

Калибровочные (по молекулярной массе) белки:
Высокомолекулярные белки (HMW):
|
Белок |
ММ
нативного |
ММ
субъединиц |
Источник |
|
Тироглобулин |
669,000 |
330,000 |
свинья |
|
Ферритин |
440,000 |
18,500
(220,000) |
селезенка
лошади |
|
Каталаза |
232,000 |
60,000 |
говяжья
печень |
|
Лактат-дегидрогеназа |
140,000 |
36,000 |
говяжье
сердце |
|
Альбумин |
67,000 |
67,000 |
сыворотка
быка |
Низкомолекулярные белки (LMW):
|
Белок |
ММ
субъединицы |
Источник |
|
Фосфорилаза
В |
94,000 |
мышца
кролика |
|
Альбумин |
67,000 |
сыворотока
быка |
|
Овальбумин |
43,000 |
яичный
белок |
|
Карбоангидраза |
30,000 |
эритроциты
быка |
|
Ингибитор
трипсина |
20,100 |
соевые
бобы |
|
альфа-Лактальбумин |
14,400 |
коровье
молоко |
При анализах с SDS возможно частичное разрушение белков четвертичной структуры, которое достигается более мягкими условиями денатурации (1% SDS и 1% бетта-меркаптоэтанола, нагревание при 60 С в течение 15 мин). В таких условиях можно обнаружить одновременно полуединицу ферритина (ММ 220,000) и субъединицу (ММ 18,500). Без денатурации нативный ферритин имеет массу 440,000 Да.
|
© khassanov @ MMII - MMXVII |