томский государственный университет |
кафедра органической химии |
Факторы, влияющие на реакции нуклеофильного замещения |
С увеличением объема и числа заместителей при атакуемом атоме углерода затрудняется атака нуклеофилом. Для реакций, протекающих по бимолекулярному механизму, это сопровождается серьезными пространственными затруднениями в переходном состоянии и скорость их падает.
Напротив, реакции мономолекулярного замещения облегчаются по двум причинам:
1. Пространственные затруднения снижаются в переходном состоянии в результате образования плоского промежуточного карбкатиона:
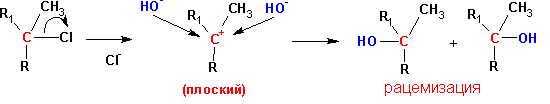
2. Алкильные заместители стабилизируют промежуточный карбкатион благодаря своим электронодонорным свойствам (+ I- эффект).
Если тыловая атака нуклеофилом невозможна из-за особенностей строения субстрата реакции, то такая реакция не протекает вообще:
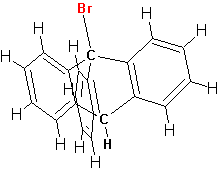
В ряде случаев пространственные затруднения значительно снижают реакционную способность даже первичных алкилгалогенидов. Так происходит в случае неопентильных производных, которые реагирую весьма медленно и лишь в результате SN1 реакции:
1. Замена одного растворителя другим может приводит к изменению механизма одной и той же реакции, что нередко используется на практике.
2. Замена растворителя может приводить к изменению сольватации и вызывать соответствующие изменения в реакции.
Так, вероятность протекания реакции по механизму SN1 тем больше, чем выше полярность (и протонность) растворителя. Например, скорость реакции гидролиза трет-бутилхлорида, протекающей в этаноле по механизму SN1 в 30 000 раз меньше скорости этой же реакции в смеси 50% этанола в воде. Смена растворителя на более полярную и протонную воду приводит к улучшению сольватации хлорид-иона, чем и ускоряется образование карбкатиона.
Примерно можно предсказать влияние растворителя на протекание реакции SN2. В полярных апротонных растворителях более реакционноспособными оказываются более нуклеофильные реагенты. Если нуклеофильная частица является двухцентровой (амбидентной), заменой растворителя на более протонный можно сдвинуть реакцию по менее электроотрицательному центру, вследствие того, что более жесткий центр сольватируется жестким же протоном.
Если используется апротонный полярный растворитель, способный сольватировать катионы, обычно маскирующие нуклеофильный центр, то скорость реакции способна резко возрасти. В таких условиях более реакционноспособным становится более жесткий центр. Например, цианистый калий в среде диметилсульфоксида или диметилформамида реагирует с образованием изонитрилов. Изонитрилы образуются также при реакциях, склонных протекать в условиях SN1 замещения, например, если увеличить жесткость переходного состояния в алкилиодиде с использованием иона серебра:
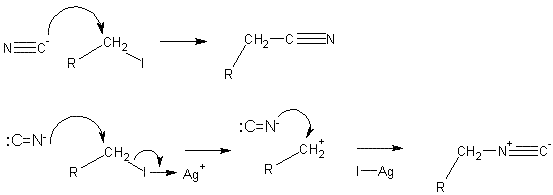
Полярные протонные растворители, а также неполярные апротонные растворители способствуют протеканию реакции по менее жесткому нуклеофильному центру, так как более жесткие центры сольватированы. В таких условиях преимущественно образуются нитрилы.
С другой стороны, в полярных протонных растворителях происходит лучшая диссоциация вторичных галоидных алкилов, образуются более жесткие кислотные центры карбкатионов, что способствует атаке жесткими нуклеофильными центрами (азотом) и образование изонитрилов. Поэтому одновременное действие взаимно противоположно действующих факторов предсказать довольно сложно.
При переходе от третичных к первичным галогенпроизводным должна увеличиваться доля нитрилов, поскольку снижается жесткость электрофильного центра- углерода, с которым связан галоген.
Полярность растворителя имеет решающее значение на состояние и скорость образования переходного состояния (ПС) из ИС (исходного состояния). Если поляризация (разделение зарядов) в исходном состоянии выше, чем в переходном, то увеличение полярности растворителя будет снижать скорость реакции. Если в переходном состоянии разделение зарядов сильнее, чем в исходном состоянии, скорость реакции будет возрастать с увеличением полярности.
Замена вступающей группы (на более нуклеофильную, например) не приводит к изменению скорости реакции, протекающей по механизму SN1 (они не принимают участия на стадии, определяющей скорость реакции).
Если же реакция протекает по механизму SN2, то скорость реакции возрастает с увеличением нуклеофильности атакующей частицы. Очень часто понятия «нуклеофильность» и «основность» совпадают, но не всегда.
Если рассмотреть ряд нуклеофилов: Н2О, СН3СОО-, С6Н5О-, С2Н5О- в реакции замещения галогена в алкилгалогениде, то окажется, что в случае с водой реакция идет по механизму SN1, а в случае с этилатом- уже по механизму SN2.
Если же речь идет о галогенах, то более нуклеофильными в протонных (сольватирующих) растворителях являются более крупные ионы и реакционная способность изменяется в направлении: J- > Br- > Cl- > F-. Аналогично, анионы R-S- более реакционно способны, чем R-O-.
При реакции в несольватирующих апротонных растворителях, реакционная способность анионов соответствует изменению их основности, то есть меняется на противоположную: J- < Br- < Cl- < F-, а R-S- < R-O-.
Более реакционноспособный иод является одновременно и наиболее легко уходящим из всех галогенов. Поэтому его часто используют в качестве катализатора при проведении реакции в протонных растворителях. Он легко замещает другой галоген из алкилгалогенида, после чего легко замещается сам в результате атаки молекулой воды.
Амбидентные нуклеофилы (СN, SCN, NO2, феноляты, еноляты и т.д.)
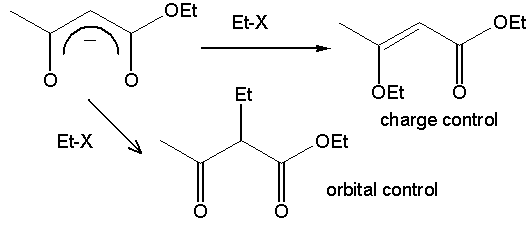
1. Реакции по более жесткому нуклеофильному центру ( :С=N-) способствуют:
а) жесткие электрофильные центры: третичный карбкатион, сильно электроотрицательная уходящая группа, ионы Ag+:
Уходящая группа (Х) |
CF3-SO3- (трифторметилсульфат) |
Ts- (тозилат) |
Br- |
I- |
соотношение алкилирования С:О |
65:35 |
85:15 |
98,5:1,5 |
100:1 |
б) полярные апротонные растворители
Более жесткие электрофилы (субстрат реакции):
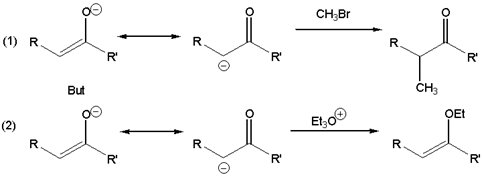
2. Реакции по мягкому нуклеофильному центру (-С=N) способствуют:
а) мягкие электрофильные центры (галоидный алкил)
б) апротонные неполярные или полярные протонные растворители;
в) жесткие кислоты Льюиса, такие как Na+, К+ (маскируют жесткий нуклеофильный центр).
Общим правилом является: чем выше основность уходящей группы, тем труднее она будет замещаться атакующим нуклеофилом. Однако, подобные группы могут быть легко замещены в кислой среде, когда в результате предварительного протонирования улучшаются условия для атаки нуклеофилом (больший положительный заряд на атоме углерода), а сама группа уходит в виде нейтральной молекулы.
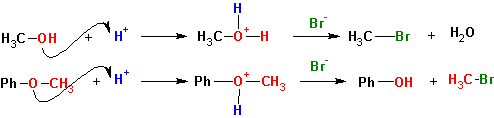
Использование HJ для расщепления простых эфиров вызвано тем, что ион иода является наиболее сильным нуклеофилом в сильнокислой среде, когда другие нуклеофилы «эффективно» сольватированы и теряют свою реакционную способность.
Скорость реакции, протекающей по механизму SN1 зависит от природы покидающей группы, чем ниже энергия связи этой группы с атакуемым атомом углерода, тем легче идет замещение по механизму SN1.
ВЕРНУТЬСЯ НА НАЧАЛЬНУЮ СТРАНИЦУ
© khassanov, MMII-MMXV |