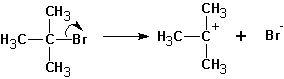
РЕАКЦИИ ЭЛИМИНИРОВАНИЯ (Е1, Е2) |
Реакции элиминирования являются конкурентно протекающими с реакциями нуклеофильного замещения у насыщенного атома углерода SN1 и SN2. Направление реакции в сторону Е1 или Е2 зависит от ряда факторов:
-структура субстрата;
-структура атакующего нуклеофила;
-основность атакующей частицы;
-природа растворителя.
Мономолекулярное элиминирование Е1.
Схема реакции совпадает со схемой мономолекулярного замещения до момента образования карбониевого катиона, т.е. отсоединения уходящей группы:
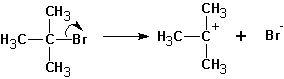
Далее протекает либо реакция замещения, либо (в зависимости от среды и атакующей частицы) отщепление протона и образование продукта элиминирования:
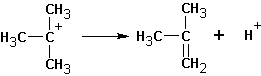
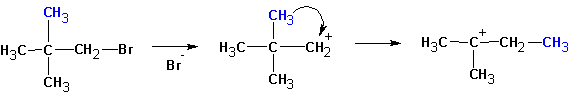
Если существует возможность образования нескольких алкенов, то преимущественно образуются наиболее замещенные алкены. Однако, такая ситуация наблюдается тогда, когда максимально замещенный алкен не имеет пространственных затруднений, как у ниже приведенного (I):
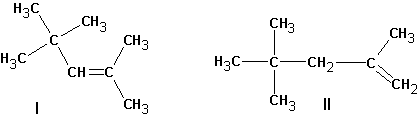
В этом случае предпочтительно образование алкена (II).
Особенностями реакций SN1 и Е1 является тенденция к перегруппировке образовавшегося карбкатиона:
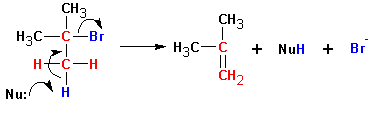
Бимолекулярное элиминирование Е2.
Механизм реакции общих этапов с реакцией SN2 не имеет. Обычно протекает транс- элиминирование по схеме:
Влияние структурных факторов:
- для органических галогенидов с заданным R скорость отщепления меняется в зависимости от уходящей группы (Х) в следующем порядке: J > Br > Cl > F.
- при фиксированном Х скорость отщепления следует порядку: третичный R > вторичный R > первичный R. Пространственные препятствия оказывают на реакции Е2 очень слабое влияние по сравнению с реакциями SN2. Отщепление в случае третичных галогенидов происходит очень легко.
Влияние атакующей частицы.
Для проведения Е2 реакций обычно требуются сравнительно сильные основания. В ряду оснований эффективность изменяется параллельно их силе: H2N- > C2H5O- > HO- > CH3COO- .
Соответственно, протеканию нуклеофильного замещения способствуют слабоосновные реагенты, подобные иодид- или ацетат-ионам.
Отщепление также преобладает над замещением при повышенных температурах.
В случае алкилгалогенидов с различными алкильными остатками существует возможность образования двух алкенов:
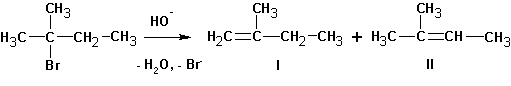
Для большинства реакций отщепления типа Е2 характерно образование наиболее замещенного алкена типа II. Однако в том случае, когда уходящая группа имеет большой объем или обладает сильными электроноакцепторными свойствами, а также если атакующее основание имеет большой объем, может оказаться более благоприятным образование наименее стабильного (наименее замещенного) алкена.
|
Состав продуктов Е2-реакции 2-пентильных производных (см. выше) при использовании этилата калия в этаноле. |
уходящая группа |
количество продукта отщепления, % |
|
|
2-метилпентен-1 (I) |
2-метилпентен-2 (II) |
||
|
-Br |
31 |
69 |
|
|
-J |
30 |
70 |
|
|
-OSO2R |
48 |
52 |
|
|
-S+(CH3)2 |
87 |
13 |
|
|
-N+(CH3)3 |
98 |
2 |
|
Большой объем уходящей группы приводит к тому, что основание атакует более доступный атом водорода крайней метильной группы.
|
Состав продуктов Е2-реакции трет-амилбромида (см. выше) с алкоголятами калия. |
основание (алкоголят-ион) |
количество продукта отщепления, % |
|
|
|
|
||
|
|
30 |
70 |
|
|
|
72,5 |
27,5 |
|
|
|
77,5 |
22,5 |
|
|
|
88,5 |
11,5 |
|
В данном случае большой объем атакующего основания приводит к тому, что легче отщепляются (в виде протона) более доступные крайние атомы водорода.
Реакции отщепления Е2 происходит наиболее легко в том случае, если молекула может принять такое пространственное расположение, когда уходящие группы Н и Х расположены в транс-положении:
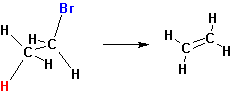
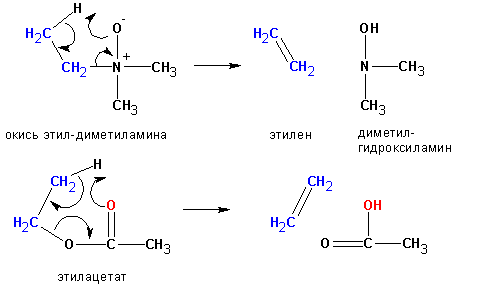
Некоторые реакции отщепления, сходные с пиролизом окисей аминов, протекают по цис- направлению. Уходящая группа в таких случаях одновременно является основанием, отщепляющим протон:
Изменение природы растворителя может приводить к получению разных продуктов. Так, реакция изобутилбромида со спиртовой щелочью приводит к образованию ряда продуктов:
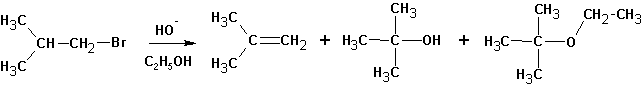
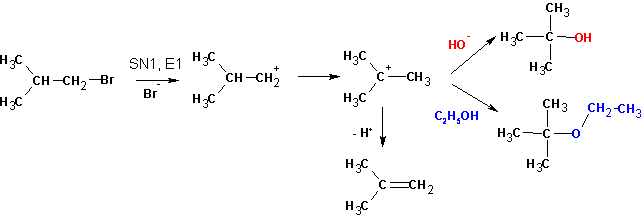
Судя по образовавшимся продуктам, протекают реакции SN1 (наблюдается перегруппировка углеводородного скелета и образование всех возможных продуктов замещения) и конкурирующая с ними Е1. Протекание реакции Е2 маловероятно, но не исключено. Продуктов реакции SN2 не обнаруживается вовсе:
А та же самая реакция в среде пиридина (или третичных аминов) протекает только с элиминированием:
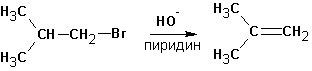
Этому явлению есть одно объяснение. Протекание реакции SN2 затруднено в обоих растворителях из-за стерических препятствий. Способность спирта сольватировать анионы (протонный растворитель) во-первых облегчает протекание реакции SN1, во-вторых- несколько снижает нуклеофильную силу и основность гидроксил-иона. В случае пиридина или третичных аминов (которые совершенно не сольватируют анионы, но зато хорошо связывают протон и катионы и к тому же являются слабыми нуклеофилами) создаются почти исключительные условия для протекания реакций элиминирования и, вероятно, по механизму Е2.
ВЕРНУТЬСЯ НА НАЧАЛЬНУЮ СТРАНИЦУ
Нуклеофильное замещение SN1, SN2