|
Томский государственный университет |
||
|
кафедра органической химии |
||
|
Альдегиды и кетоны |
||
Альдегиды и кетоны отличаются наличием карбонильной группы >С=О.
Карбонильная группа поляризована по связи С-О:
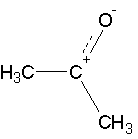
Альдегиды и кетоны можно рассматривать, как производные алканов, у которых одна из метильных (-СН3) или метиленовых групп (-СН2-) заменена на карбонильную группу:
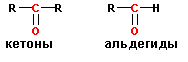
Кетоны имеют в качестве заместителей при карбонильной группе два алкильных
радикала, тогда как в альдегидах один заместитель- алкильная группа, другой- водород. Такое различие
приводит к существенным различиям в химических свойствах (см. ниже).
Номенклатура
Номенклатура IUPAC
При наименовании альдегидов и кетонов по правилам номенклатуры ИЮПАК выбирается самая длинная цепь углеродов, включающая в себе карбонильную группу. Нумерация атомов углерода в этой цепи производится с того края, куда ближе карбонильная группа, а при формировании названия к названию углеводорода, соответствующему числу атомов углерода в основной цепи (1-метан, 2- этан, 3-пропан, 4-бутан, 5 –пентан и т.д.) прибавляется окончание -аль (для альдегидов) или -он для кетонов.
Положение карбонильной группы у кетонов указывается через тире, если возможно существование нескольких изомеров. Положение карбонильной группы альдегидов не указывается цифрой, поскольку во всех случаях она оказывается под первым номером:
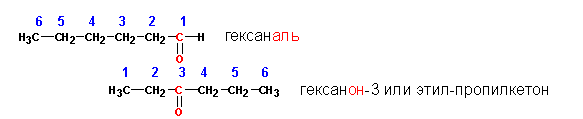
Рациональная номенклатура
Кетоны часто называют по радикалам, соединенным через карбонильную группу, с добавлением слова кетон. Например, гексанон-3 или метилэтилкетон, ацетон или диметилкетон.
Альдегиды могут быть названы, как производные этаналя или уксусного альдегида:

Другое название- триметилэтаналь.
Химические свойства карбонильных соединений
Все реакции карбонильных соединений можно разделить на группы:
- реакции по карбонильной группе (присоединение)
- реакции по углеродному скелету
- реакции окисления
- реакции восстановления
Реакции присоединения по карбонильной группе (присоединение нуклеофильных реагентов)
1. присоединение воды
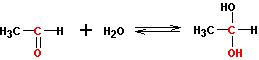
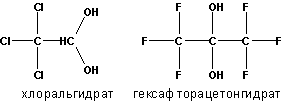
Образующиеся гем-диолы неустойчивы и равновесие в этой реакции сильно смещено влево. Исключение составляют альдегиды и кетоны с электроноакцепторными группами, например, хлораль или гексафторацетон, которые в водной среде существуют в виде гем-диолов:
2. присоединение бисульфита
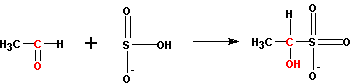
Присоединение идет через более нуклеофильный атом серы, а не кислорода, хотя на нем и имеется отрицательный заряд. Образуются производные алкансульфокислот (соли алканоксисульфокислот).
Образующиеся аддукты нерастворимы в насыщенном растворе бисульфита натрия или спиртах и выпадают в осадок в виде кристаллов. Так можно отделять карбонильные соединения из смеси со спиртами. Карбонильное соединение выделяется в свободном виде из аддукта при обработке его кислотой.
При реакции с кетонами бисульфиты присоединяются только к метилкетонам СН3-СО-R.
3. присоединение цианидов
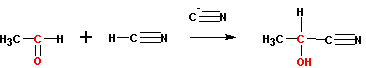
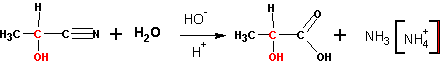
Реакция катализируется цианистым калием или натрием. Образующиеся оксинитрилы (или циангидрины) могут быть гидролизованы до оксикарбоновых кислот:
4. присоединение спиртов
При присоединении первой молекулы спирта образуются полуацетали. Реакция катализируется кислотами или основаниями:
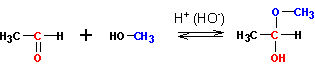
Присоединение второй молекулы спирта приводит к образованию ацеталей. Образование ацеталей катализируется только в кислой среде:
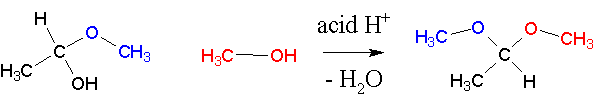
Ацетали устойчивы в нейтральной и щелочной среде, поэтому могут быть использованы для временной защиты альдегидных групп. Ацетали широко распространены в природе.
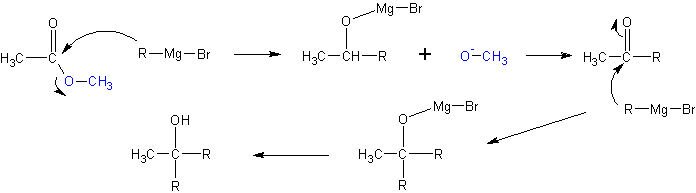
5. присоединение реактивов Гриньяра
Взаимодействие металлорганических соединений типа R-Mg-X (реактивы Гриньяра), где Х= галоген, с карбонильными группами (нуклеофильное присоединение по кратной связи С=О):
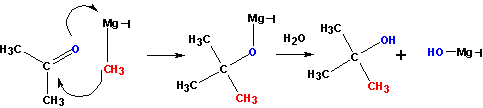
Взаимодействие с формальдегидом, альдегидами, кетонами- приводит к первичным, вторичным и третичным спиртам, соответственно.
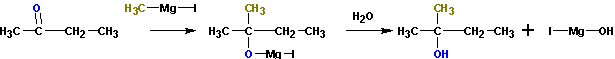
Из кетонов получаются третичные спирты. Так, из метилэтилкетона (бутанон-2) получается
2-метилбутанол-2. Альдегиды в подобной реакции дают вторичные спирты. Из пропионового альдегида (пропаналь) получается бутанол-2:
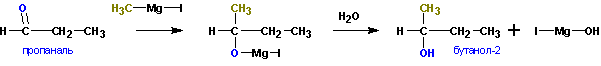
Из формальдегида образуются первичные спирты. При взаимодействии реактивов Гриньяра с галогенангидридами карбоновых кислот и сложными
эфирами образуются третичные спирты, у которых имеется два одинаковых алкильных
заместителя. При этом расходуется два моля реактива Гриньяра:
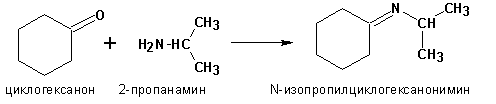
6. Присоединение аммиака и аминов
Первичные амины присоединяются к альдегидам и кетонам с образованием иминов (оснований Шиффа:
Аналогичная реакция вторичных аминов с карбонильными соединениями дает енамины:
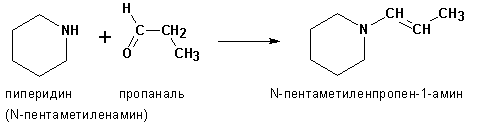
С карбонильными соединениями могут вступать во взаимодействие также гидразин и его производные с образованием гидразонов:
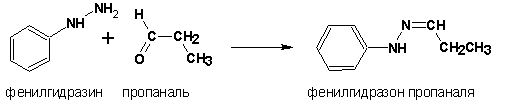
Гидроксиламины присоединяются к альдегидам и кетонам с образованием альдоксимов и кетоксимов:
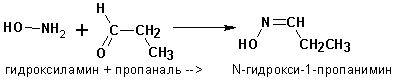
7. Альдольно-кротоновая конденсация
Конденсация может происходить как в кислой среде, так и в щелочной.
Катализируемая кислотой конденсация
В конденсацию вступают енол и протонированная
карбонильная группа второй молекулы соединения:
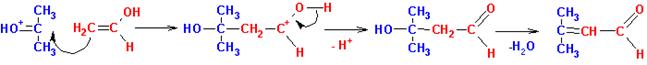
Конденсация, катализируемая основанием
Образование енолят-иона, генерирующего
карбанион, протекает по
схеме:
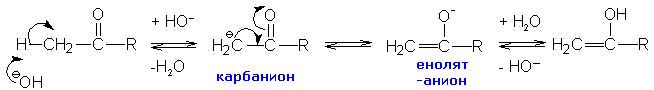
Далее карбанион
присоединяется к карбонильной группе второй молекулы, причем протекает С-алкилирование, в отличие от термодинамически невыгодного О- алкилирования:
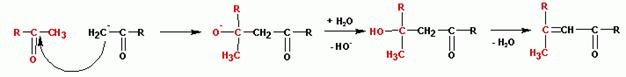
Образующийся альдегидоспирт (альдоль) легко теряет воду в присутствии каталитических количеств оснований или кислот, а также при незначительном нагревании, с образованием a,b- ненасыщенного карбонильного соединения, этим завершается реакция конденсации (R,Х= алкил или Н):
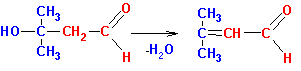
Таким образом, в реакцию альдольно- кротоновой конденсации (в том числе и самоконденсации) могут вступать как альдегиды, так и кетоны, имеющие альфа-углеродные атомы водорода. В случае кетонов положение равновесия невыгодно для образования продуктов, тем не менее, проводя реакцию в особых условиях (например, исключая контакт продукта с катализатором основного характера) можно добиваться существенных выходов. Перекрестные реакции между альдегидами и кетонами не имеют лабораторного применения, поскольку образуется трудноразделяемая смесь из четырех продуктов и непрореагировавших исходных соединений. Чаще в синтетических целях проводят реакцию между двумя карбонильными соединениями, одно из которых является источником карбанионов (метиленовая компонента), а другое служит карбонильной компонентой (не имеющей альфа-углеродных атомов водорода). Обычно в роли карбонильной компоненты используются формальдегид, ароматические альдегиды, эфиры угольной, щавелевой и муравьиной кислот. В качестве метиленовой компоненты применяют в том числе и С-Н кислоты и даже производные ацетиленовых углеводородов с концевой тройной связью.
Альдегиды, не имеющие альфа-углеродных атомов водорода при нагревании с сильными основаниями вступают в реакцию окисления-восстановления, когда одна из молекул восстанавливается до спирта за счет окисления второй молекулы до карбоновой кислоты. Такие реакции носят название реакции Канниццаро, и протекают по схеме:
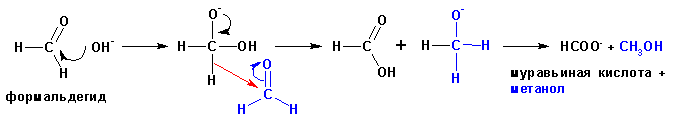
Известны и внутримолекулярные реакции окисления-восстановления:
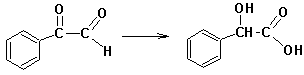
Cвоеобразной разновидностью внутримолекулярного окисления-восстановления является Бензиловая перегруппировка:
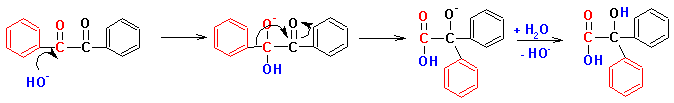
Реакции по углеродному скелету альдегидов и кетонов
Реакции, затрагивающие углеродный скелет, включают:
- кето-енольная таутомерия альдегидов и кетонов;
- галогенирование (галоформная реакция и замещение a- углеродных атомов водорода)
1. Кето-енольная таутомерия
Карбонильные соединения могут сосуществовать в двух формах- кетонной и енольной:
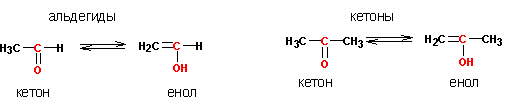
Превращения альдегидов и кетонов в енолы (непредельные спирты) протекает как самопроизвольно, так и с катализом кислотами и основаниями. Енольные формы хоть и присутствуют в альдегидах и кетонах в незначительных концентрациях, но роль в их реакционной способности играют существенную. Через образование енолов идет целый ряд важных реакций альдегидов и кетонов. Рассмотрим механизмы перехода кетонных форм в енольные, протекающие при каталитическом действии кислот и оснований.
Енолизация, катализируемая кислотой
Образование енола может катализироваться кислотой согласно нижеприведенной схеме (R'= алкил или Н):
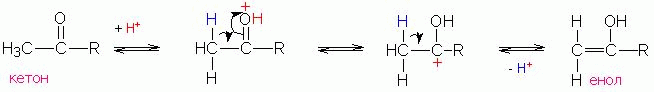
Реакция начинается с протонирования атома кислорода карбонильной группы и завершается отщеплением протона уже от альфа-углеродного атома. Таким образом, формально протон играет роль катализатора.
Енолизация, катализируемая основанием
Образование енолят-иона протекает по схеме:
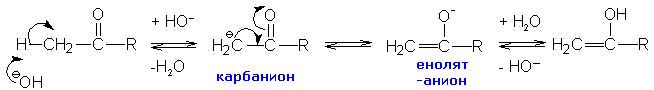
В образовании енолов при катализе основаниями важную роль играет кислотность альфа- углеродных атомов водорода. Их повышенная кислотность связана с близким соседством с карбонильной группой и ее отрицательным индуктивным эффектом, оттягивающим электроны связи С-Н и облегчающим таким образом отщепление протона. Другими словами, отщепление протона облегчено потому, что образующийся карбанион стабилизирован делокализацией отрицательного заряда на карбонильную группу.
К образовавшимся енолам присоединяются галогены по кратной связи С=С. Только в отличие от алкенов, где такое присоединение завершается полным связыванием галогена, у альдегидов и кетонов присоединяется только один атом галогена (на соседний с карбонильной группой углерод). Второй атом галогена (на карбонильную группу) не присоединяется, а реакция завершается отщеплением протона и регенерацией карбонильной группы:
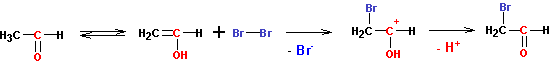
В кислой среде реакция на этом и останавливается. Замещения второго атома водорода на галоген не происходит. А вот в щелочной среде происходит быстрая реакция замещения второго, и еще более быстрая реакция замещения третьего атома углерода на галоген (увеличение числа атомов галогена при углероде резко усиливает кислотность его водородов):
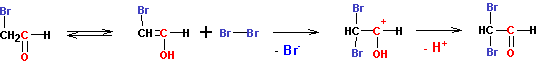
В конечном итоге все три атома водорода оказываются замещены на галогены, после чего следует отщепление группировки СХ3 в виде аниона, с последующим немедленным обменом протоном:
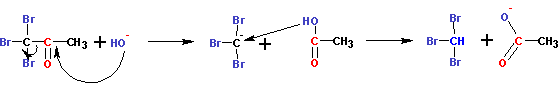
В результате образуется тригалогенметан, называемый галоформом (иодоформ CHJ3, бромоформ CHBr3, хлороформ CHCl3) и анион карбоновой кислоты. А сам процесс называется галоформной реакцией. Галоформной реакции подвержены любые метилкетоны. Галоформы выпадают в виде окрашенного осадка (желтый иодоформ), имеют специфический запах и могут служить качественной реакцией на присутствие метилкетонов. Галоформную реакцию дают также спирты, при окислении которых могут образоваться метилкетоны (например, изопропанол). Окисление осуществляется избыточным количеством галогена.
Окисление альдегидов и кетонов
Альдегиды легко окисляются до соответствующих кислот:
|
|
Кетоны окисляются с трудом, в жестких условиях. Окисление сопровождается
разрывом С-С связи по соседству с карбонильной
группой. В результате получается набор продуктов окисления-
карбоновые кислоты с разной длиной углеродной цепи:
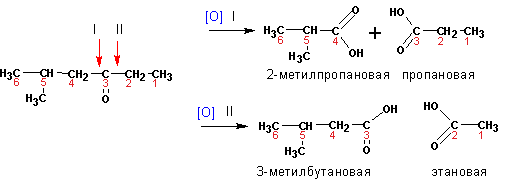
Методы получения
1. Окислением первичных спиртов получают альдегиды, а вторичные спирты дают кетоны:
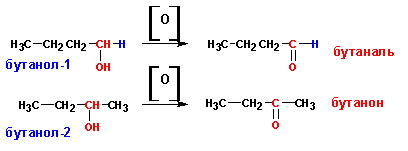
Окисление можно осуществлять «сухим» и «мокрым» методами. Первый заключается в пропускании паров спирта через нагретую до 300-350 С окись меди CuO. «Мокрым» методом называется окисление спиртов подкисленным раствором бихромата калия или натрия:
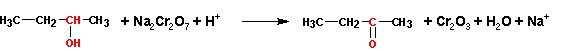
При окислении «мокрым» методом образующийся альдегид следует отгонять из
сферы реакции, в противном случае он легко окисляется дальше, до карбоновой
кислоты: 
2. Альдегиды и кетоны получаются при гидролизе гем-дигалогеналканов

Вначале происходит замещение двух атомов галогена на гидроксильные группы. Но
неустойчивые гем-диолы
быстро перегруппировываются в карбонильные соединения с отщеплением молекулы
воды:

3. Озонолиз
алкенов
приводит к образованию смесей альдегидов и кетонов, в зависимости от строения исходного алкена:

На первом этапе озонирования получается озонид, при разложении которого водой образуются карбонильные соединения и перекись водорода. Чтобы перекись не спровоцировала дальнейшее окисление альдегидов, в воду при разложении озонидов добавляют цинковую пыль. Озонирование алкенов имеет целью не столько синтез альдегидов и кетонов, сколько определение места положения кратной связи:
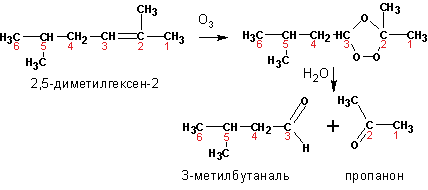
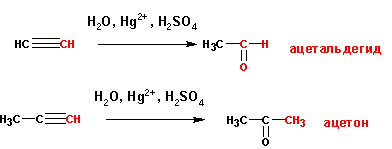
4. Присоединение воды к алкинам
Присоединение воды к тройной связи в присутствии солей ртути приводит в случае ацетилена к уксусному альдегиду, а в случае замещенных ацетиленов- к кетонам. Вода присоединяется по правилу Марковникова:
|
© khassanov, MMII-MMXVII |