Tомский государственный университет |
кафедра органической химии |
Кислородсодержащие соединения. Спирты |
Строение и классификация спиртов
Номенклатура спиртов
Химические свойства одноатомных спиртов
Механизмы галогенирования спиртов
Способы получения спиртов
Реакции двухатомных спиртов
Получение двухатомных спиртов
Строение и классификация спиртов
Спиртами называют производные углеводородов, содержащие вместо одного или нескольких атомов водорода одну или несколько гидроксигрупп (-OH). Общая формула спиртов, таким образом, R-OH.
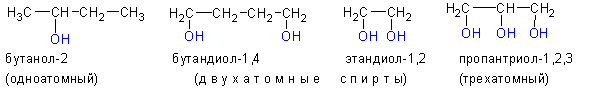
1. По числу гидроксильных групп в молекуле спирты разделяют на одноатомные, двухатомные, трехатомные и т.д. до многоатомных.

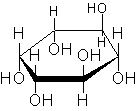
Многоатомные спирты
Среди многоатомных спиртов наиболее известен шестиатомный циклический спирт инозит:
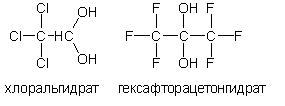
Двухатомные спирты (диолы) с гидроксилами у одного атома углерода (геминальныедиолы). Нестабильны в индивидуальном состоянии. Обнаруживаются в незначительных количествах только в водных растворах. Наиболее устойчивы двухатомные спирты (существует исключительно в растворе) хлоральгидрат CCl3-C(OH)2 и гексафторацетонгидрат (CF3) 2C(OH)2:
2. По строению углеводородной цепи спирты разделяют на предельные (насыщенные спирты) и непредельные.

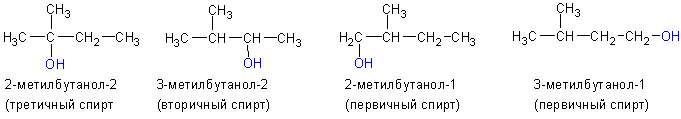
3. По положению гидроксильной группы в цепи различают первичные, вторичные и третичные спирты:
Номенклатура IUPAC
При наименовании спиртов по номенклатуре IUPAC находят самую длинную цепь атомов углерода, содержащую гидрокисльную группу, и нумеруют ее с края, к которому ближе гидроксильная группа. После перечисления заместителей добавляется название, соответствующее углеводороду главной цепи с добавлением окончания –ол и цифры, показывающей место гидроксильной группы в цепи (см. примеры выше).
Заместительная номенклатура используется достаточно редко. По ней спирты называют, как производные карбинола (метанола). Например, фенилкарбинол- бензиловый спирт (оксиметилбензол), этилкарбинол- пропиловый спирт (или пропанол), винилкарбинол- пропен-2-ол-1, или аллиловый спирт.
Тривиальная номенклатура, напротив, до сих пор широко применяется. Метанол (метиловый спирт, муравьиный спирт), пропиловый спирт, группа амиловых спиртов (С5) и т.д. Не говоря уже о непредельных спиртах, которые практически только и называются тривиальными названиями- аллиловый и пропаргиловый спирты (см. выше).
Физические свойства
Одноатомные спирты-жидкости с характерным запахом, начиная с метанола (С1) и до нонанола (С9). Высшие спирты запаха практически не имеют. Группа спиртов С4-С5 имеет характерный запах сивухи, а сами они носят неофициальное определение сивушных спиртов или масел. Двухатомные спирты с гидроксилами у разных атомов водорода обладают гораздо большей температурой кипения и вязкостью, чем одноатомные спирты. Этиленгликоль (Ткип=197 оС), глицерин (Ткип=290 оС, разложением), бутандиол-1,4 (Ткип=213 оС). Температуры кипения многоатомных спиртов гораздо выше, чем у одноатомных (а у одноатомных спиртов температуры кипения гораздо выше, чем у соответствующих алканов) по причине образования межмолекулярных водородных связей. Шестиатомный спирт инозит- твердое кристаллическое соединение.
1. Реакции дегидратации спиртов (внутри- и межмолекулярная дегидратация)
При кипячении с кислотами спирты могут образовывать алкены и простые эфиры.
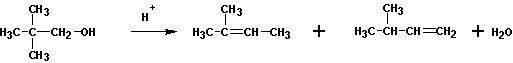

Как правило, получаются смеси продуктов. Преобладание того или иного соединения связано с условиями проведения реакции. Так, при повышении температуры выход алкенов увеличивается. Выходы алкенов также возрастают при переходе от первичных к третичным спиртам. Очень часто перечисленные реакции сопровождаются перестройками в углеродном скелете:
Образование простых эфиров (межмолекулярная дегидратация спиртов).
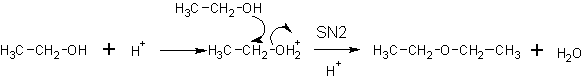
В присутствии серной кислоты:
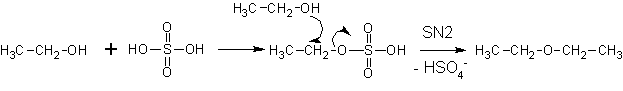
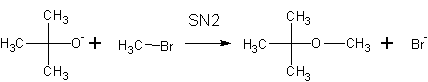
Более предпочтительно получение простых эфиров по реакции Вильямсона- (суть- нуклеофильные замещения у атома углерода).
Пример получения метил-третбутилового эфира (МТБЭ) реакциями:
При неправильном выборе сочетания реагентов в реакции Вильямсона вместо ожидаемого эфира можно получить алкен. Реакции нуклеофильного замещения с образованием эфира способствует реакция крупного основания и мелкого галогенида, неспособного к элиминированию:
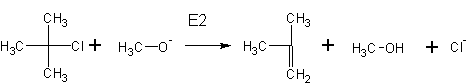
2. Образование галоидных алкилов из спиртов происходит при реакции с различными реагентами:
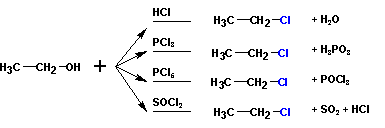
Во всех случаях наиболее гладко протекают реакции с первичными спиртами,
третичные спирты чаще дают различные побочные продукты.
Механизмы галогенирования спиртов тионилхлоридом (SOCl2) и галогенидами фосфора
Тионилхлорид образует со спиртами эфиры хлорсернистой кислоты (хлорсульфиты):
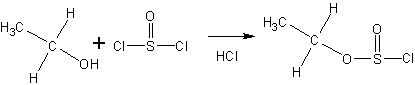
При этом генерируется некоторое (заметное) количество анионов хлора.
Дальнейшее течение реакции зависит от типа растворителя, в котором она протекает. В случае диоксана, например, происходит сольватация хлорид-ионов и атака диоксаном:
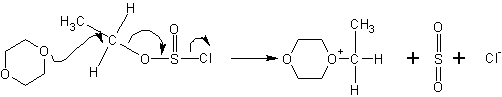
Полученное промежуточное соединение атакуется повторно анионами Cl- с противоположной стороны, в результате чего не происходит обращения оптической конфигурации (если сравнивать с исходным спиртом):
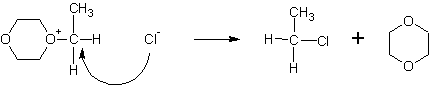
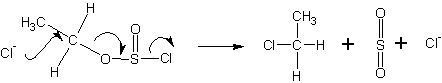
Однако, в таких растворителях, как пиридин или гексаметилфосфотриамид (НМРТ), концентрация свободных ионов хлора достаточно велика, чтобы атаковать эфиры хлорсульфита с образованием галогенпроизводных спирта с обращенной конфигурацией:
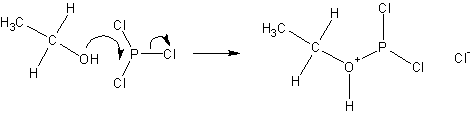
Реакции с галогенидами фосфора протекают с обращением конфигурации согласно ниже приведенной схеме;
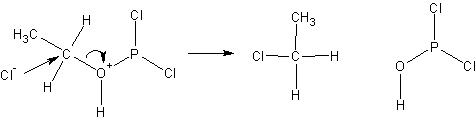
После чего хлорид ион- замещает группировку с атомом фосфора:
3. Кислотные свойства спиртов
При взаимодействии с сильными основаниями и щелочными металлами спирты ведут себя как кислоты:
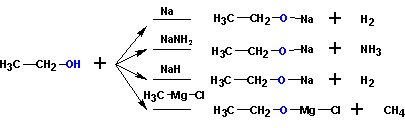
4. Окисление спиртов
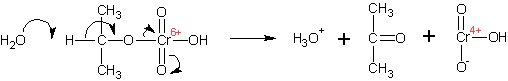
Спирты окисляются различными окислителями до альдегидов (первичные спирты) и кетонов (вторичные спирты). Механизм окисления спиртов хромовой кислотой:

Образующиеся вначале эфиры хромовой кислоты претерпевают отщепление протона от атома углерода, при котором стояла гидроксильная группа (вследствие повышения его кислотности в результате образования эфира, он отщепляется даже таким слабым основанием, как вода):
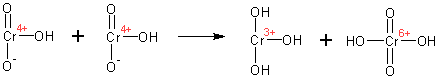
Образуется продукт окисления и хромистая кислота (Cr IV). Хромистая кислота быстро диспропорционирует до гидроокиси хрома (Cr III) и хромовой кислоты (Cr VI):
Если таким образом окисляются вторичные спирты, то образующиеся кетоны сравнительно устойчивы, однако, при окислении первичных спиртов образуются альдегиды, которые легко окисляются дальше- до карбоновых кислот (если не предпринимать меры предосторожности). Альдегиды с небольшим числом атомов углерода можно выделить из реакционной смеси отгонкой в процессе получения, однако, для более тяжелых альдегидов такой способ не помогает.
Окисление спиртов реагентом Саретта (Sarett)- смесью хромового ангидрида и пиридина позволяет выделять альдегиды.
Третичные спирты в нейтральной и щелочной среде окисляются с трудом и с разрушением углеродного скелета. В кислой среде окисляется предварительно образовавшийся алкен, углерод-углеродная связь рвется по месту кратной связи (см. алкены). Если не удалять из реакционной среды образовавшиеся альдегиды, окисление идет дальше и образуются карбоновые кислоты:
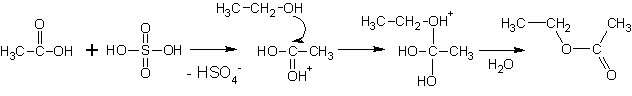
5. Образование сложных эфиров
Сложные эфиры образуются при реакции спиртов с минеральными и органическими кислотами.
(Реакции протекают при умеренном нагревании, кислотный катализ).
6. Образование ацеталей и полуацеталей
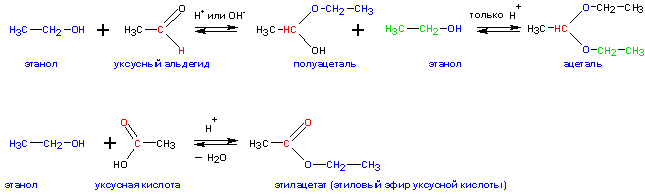
Спирты взаимодействуют с альдегидами и
кетонами- с образованием полуацеталей и ацеталей (альдегиды) и полукеталей и кеталей (кетоны):
Реакции образования ацеталей и полуацеталей используются в синтетической практике для временной защиты альдегидных групп (чтобы не допустить их окисления). Ацетали и полуацетали широко распространены в природе. Альдегидные группы регенерируются в кислой среде. В нейтральной и щелочной среде ацетали устойчивы.
Ацетали представляют собой жидкости с приятным эфирным запахом.
1. Гидратация алкенов (правило Марковникова):
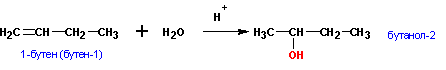
Алкены присоединяют воду в кислой среде по механизму электрофильного присоединения, по правилу Марковникова. (через промежуточное образование карбкатионов, см. химические свойства алкенов).
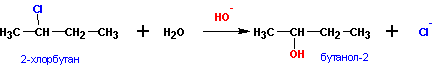
2. Гидролиз галоидных алкилов:
а) обратимый гидролиз в кислой среде;
б) необратимый гидролиз в щелочной среде:
3. Взаимодействие металлорганических соединений (реактивы Гриньяра) с карбонильными группами (нуклеофильное присоединение по кратной связи С=О):
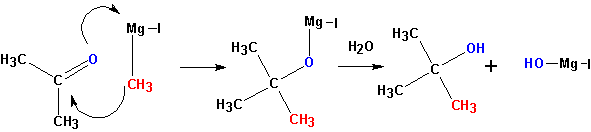
Взаимодействие с формальдегидом, альдегидами, кетонами- получение первичных, вторичных и третичных спиртов.
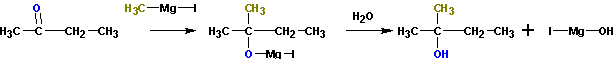
Из кетонов получаются третичные спирты. Так, из метилэтилкетона (бутанон-2) получается 2-метилбутанол-2. Альдегиды в подобной реакции дают
вторичные спирты. Из пропионового альдегида (пропаналь) получается бутанол-2:
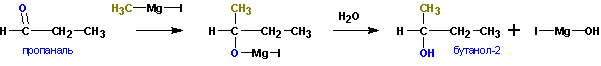
Из формальдегида образуются первичные спирты.
Взаимодействие реактивов Гриньяра со сложными эфирами карбоновых и муравьиной кислоты- приводит к получению третичных и вторичных спиртов, соответственно.
4. Восстановление альдегидов, кетонов
Менее распространены способы получения спиртов восстановлением альдегидов и кетонов.
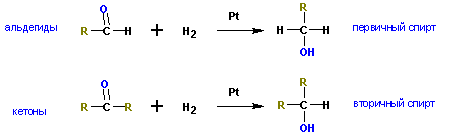
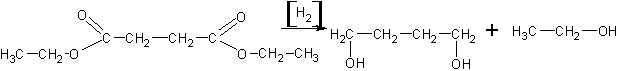
5. Восстановление сложных эфиров (каталитические и некаталитические).
Получение спиртов восстановлением сложных эфиров по Буво-Блану (кипячение с натрием).
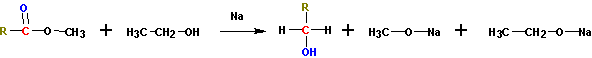
6. Расщепление простых эфиров HJ и HBr
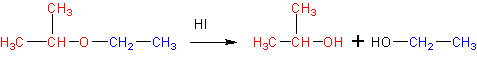
Реакция представляет собой нуклеофильное замещение в алкилоксонии:
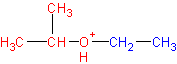
который образуется в кислой среде из эфира в результате протонирования атома кислорода. В качестве эффективного нуклеофила в кислой среде с успехом выступает иодид-ион, который атакует соседний с кислородом стерически менее затрудненный вторичный атом углерода. В итоге образуются изопропанол и иодистый этил. Иодистый этил в водной среде легко превращается в этанол, регенерируя катализатор- HJ.
Реакции двухатомных спиртов (отличные от первичных спиртов реакции).
1. внутримолекулярная дегидратация:
а) НО-СН2-СН2-ОН → СН2=СН-ОН + Н2О → СН3-СНО
б) НО-СН2-СН2-СН2-ОН → СН2=СН-СН2-ОН + Н2О
в) НО-СН2-СН2-СН2-СН2-ОН →
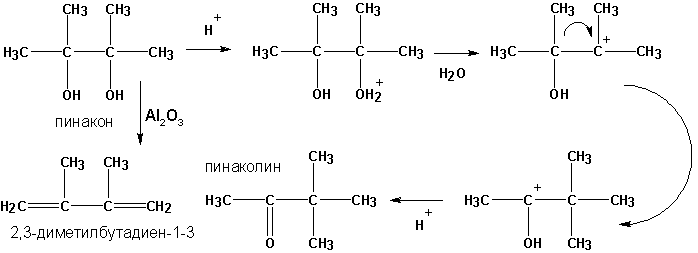
г) пинакон-пинаколиновая перегруппировка
д) дегидратация пинаконов в присутствии окиси алюминия приводит к диенам:
Межмолекулярная дегидратация:
а) образование спиртоэфиров
НО-СН2-СН2-ОН + НО-СН2-СН2-ОН → НО-СН2-СН2-О-СН2-СН2-ОН (диэтиленгликоль)
б) образование циклических эфиров:
НО-СН2-СН2-ОН + НО-СН2-СН2-ОН → диоксан
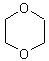
1. Гидролиз дигалогенпроизводных или хлоргидринов:
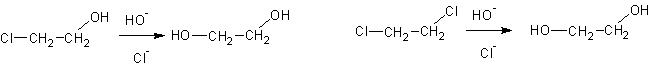
2. Гидратация альфа-окисей (эпоксидов):
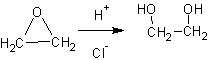
3. Окисление олефинов перекисью водорода или перманганатом (холодные растворы):
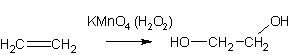
4. Каталитическое восстановление сложных эфиров дикарбоновых кислот:
© khassanov, MMII-MMXX |