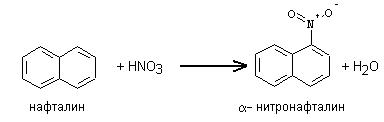Реактивы: конц. HNO3, конц. H2SO4, толуол.
Материалы и оборудование: микрохимическая пробирка, электроплитка, стаканчик с водой.
В микрохимическую пробирку вводят 1 каплю конц. азотной кислоты и 2 капли конц. серной кислоты. Затем, охлаждая пробирку под струей воды и осторожно встряхивая ее, добавляют к смеси 1 каплю толуола. Продолжают встряхивать еще некоторое время, после чего в пробирку добавляют 10 капель холодной воды. При этом в виде маслянистой жидкости всплывает смесь о- и п-нитротолуолов, имеющая характерный запах горького миндаля. Реакция протекает по уравнению:
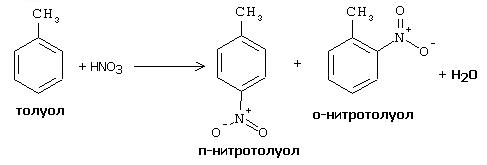
Реактивы: бромная вода, толуол.
Материалы и оборудование: микрохимическая пробирка, электроплитка, стаканчик с водой.
В микрохимическую пробирку вводят 5 капель бромной воды и 5 капель толуола, смесь подогревают в стаканчике с горячей водой, постоянно встряхивая. Наблюдают исчезновение окраски брома, в результате протекания реакции, с образованием о- и п-бромтолуолов:
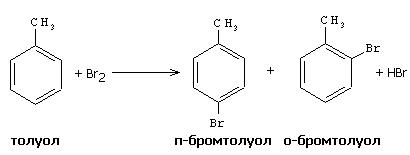
Реактивы: бромная вода, раствор фенола в воде, насыщенный.
Материалы и оборудование: микрохимическая пробирка.
В микрохимическую пробирку вводят 2 капли бромной воды и 1 каплю раствора фенола. Мгновенно образуется муть желтоватого цвета:
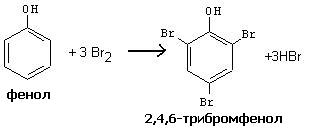 В отличие от толуола, фенол реагирует с бромом энергично, на холоду. При этом происходит замещение в три положения, поскольку гидроксильная группа фенола сильнее активирует ароматическую систему в реакциях электрофильного замещения, чем метильная группа в толуоле.
В отличие от толуола, фенол реагирует с бромом энергично, на холоду. При этом происходит замещение в три положения, поскольку гидроксильная группа фенола сильнее активирует ароматическую систему в реакциях электрофильного замещения, чем метильная группа в толуоле.