ПРОСТЫЕ И СЛОЖНЫЕ ФЕРМЕНТЫ
ФУНКЦИИ КОФЕРМЕНТОВ (КФ) И ПРОСТЕТИЧЕСКИХ ГРУПП (ПГ)
Ферменты или Энзимы ( от греческого ЭН- в, ЗИМЕ- закваска). Впервые обнаружены в бродильном производстве, откуда и получили свое название. Все ферменты имеют белковую природу
Общие свойства ферментов и химических катализаторов небелковой природы:
1) Ф. не входят в состав конечных продуктов реакции и не тратятся в процессе катализа, выходя из реакции в неизменном виде.
2) Ф. только ускоряют реакции протекающие и без них, не могут возбудить реакций, противоречащих законам термодинамики.
3) Ф. не смещают положение равновесия, а лишь ускоряют его достижение.
Отличительные признаки ферментативного и химического катализа:
1) Скорость ферментативного катализа намного выше, чем небиологического.
Например, энергия активации реакции разложения перекиси водорода
Н2О2 а Н2О + 1/2 О2 равна 75,3 кДж/моль, поэтому самопроизвольное разложение протекает настолько медленно, что выделяющийся кислород визуально не заметен.
При добавлении неорганического катализатора- железа или платины- энергия активации снижается до 54,1 кДж/моль, реакция ускоряется в тысячи раз и становится заметной по выделению пузырьков кислорода.
Фермент каталаза, разлагающий перекись водорода, снижает энергию активации более, чем в 4 раза и ускоряет реакцию разложения в миллиард раз. Реакция протекает настолько бурно, что раствор от выделяющегося кислорода буквально вскипает.
Наконец, одна-единственная молекула фермента может катализировать при обычной температуре превращение от тысячи до миллиона молекул вещества в минуту. Эта скорость катализа недостижима для небиологических катализаторов.
2) Ферменты обладают высокой специфичностью, направляя превращение вещества в строгое русло.
3) Ферментативные процессы не дают побочных реакций, для них характерен 100% выход целевого продукта.
4) Ферменты катализируют реакции в мягких условиях, то есть при обычном давлении, небольшой температуре и значениях рН, близких к нейтральным, однако весьма чувствительны к сдвигам рН среды и изменению температуры.
5) Ферменты регулируемы. То есть они могут изменять свою активность под воздействием ряда факторов, изменяя количественные выходы продуктов. Этим обеспечивается скоординированность всех метаболических процессов во времени.
6) Скорость ферментативной реакции прямо пропорциональна количеству фермента, поэтому недостаток фермента в организме означает низкую скорость превращения какого-либо соединения, и наоборот, одним из путей приспособления организма является увеличение количества требуемого фермента.
ФЕРМЕНТЫ- ГЛОБУЛЯРНЫЕ БЕЛКИ (ПРОСТЫЕ
Ф. И СЛОЖНЫЕ Ф.)
| Ферменты- простые белки встречаются примерно в половине случаев. Если молекула фермента состоит из белковой части (полипептидная нить) и небелковой части, то это сложные ферменты. Белковая часть, называемая апоферментом, самостоятельно (т. е. без наличия небелковой части) часто нефункциональна. Небелковая часть сложного фермента, называемая КОФЕРМЕНТОМ (если сравнительно независима от белковой части молекулы) или ПРОСТЕТИЧЕСКОЙ ГРУППОЙ (если сравнительно прочно и постоянно связана с белковой частью) в комбинации с белковой частью составляет ХОЛОФЕРМЕНТ, т. е. функционально действенный энзим. Соединение в ХОЛОФЕРМЕНТ осуществляется любыми типами связей, кроме ковалентных. |
ФУНКЦИИ КОФЕРМЕНТОВ(КФ) И ПРОСТЕТИЧЕСКИХ ГРУПП (ПГ)
Наверх
1. Участие в акте катализа Апофермент, в свою очередь, усиливает каталитическую активность небелковой части (КФ и ПГ). Например, одна и та же NAD+ является КФ многих дегидрогеназ, отличие- в апоферментной части. АКТИВНЫЙ ЦЕНТР- часть молекулы Ф. где происходит связывание и превращение субстрата. У Ф., имеющих четвертичную структуру, число АЦ может быть равно числу Субъединиц. Сам АЦ функционально неоднороден и имеет КАТАЛИТИЧЕСКУЮ ЗОНУ и СВЯЗЫВАЮЩУЮ З. Связывание субстрата- многоточечное. СПЕЦИФИЧНОСТЬ Ф. бывает ОТНОСИТЕЛЬНАЯ (катализ превращений небольшой группы близких по свойствам СУБСТРАТОВ) и АБСОЛЮТНАЯ- катализ превращения только одного вещества. СТРОЕНИЕ И ФУНКЦИИ ОТДЕЛЬНЫХ КФ И
ПГ.
2. Осуществление контакта между энзимом и субстратом
3. Стабилизация апофермента
1. нуклеотидного типа строения
2. витамины и их производные
3. металлы и металлсодержащие КФ и ПГ
4. другие
НИКОТИНАМИДНЫЕ КОФЕРМЕНТЫ NAD+ и NADP+
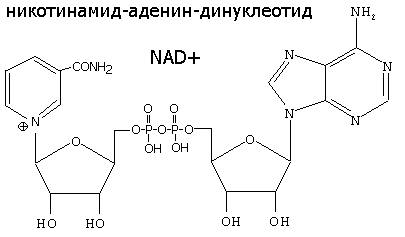
NAD+, NADP+- содержащие дегидрогеназы катализируют перенос гидрид-иона (Н-) от субстрата к никотинамидной части кофермента:
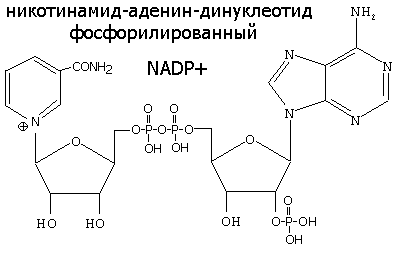
Восстановленная при этом часть кофермента отличается от окисленной только по производному никотиновой кислоты:
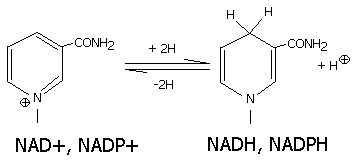
Восстановленные формы NADH и NADPH отсоединяются от апофермента и отделяются от дегидрогеназы. Затем они переносят гидрид ион на другую молекулу фермента (чаще всего- FMN, FAD-зависимого).
Катализируют обратимые реакции окисления спиртов, оксикислот, аминов и др. Хорошо изучены LDH- лактатдегидрогеназа, MDH- малатдегидрогеназа, ADH- алкогольдегидрогеназа. Для дегидрогеназ характерно наличие четвертичной структуры (ADH, MDH- димеры, LDH-тетрамер).
Спектральные различия- NAD+, NADP+- 260 nm, NADH, NADPH- 260, 340 nm).
Наверх
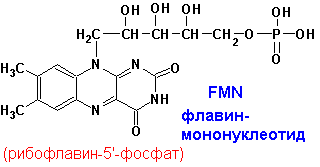
ФЛАВИНОВЫЕ ПРОСТЕТИЧЕСКИЕ ГРУППЫ
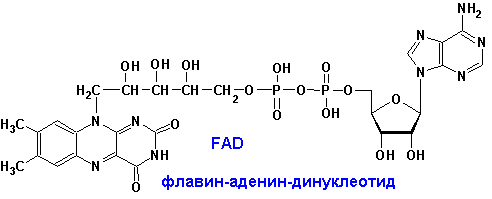 |
Изоаллоксазиновое
кольцо флавиновых ПГ имеет следующие спектральные свойства: окисленная форма-
280, 350-380, 450 нм, восстановленная- 280, 350-380 (с меньшими e).
FMN и FAD катализируют переходы: спирты-альдегиды, амины-имины, насыщ. карбонильные-a,b- ненасыщ. карбонильные, NADH, NADPH-NAD+, NADP+. |
FMN, FAD- более сильные окислители. Сами передают гидрид ион непосредственно на кислород:
FADH2, FMNH2 + O2 а FAD, FMN + H2O2
Наверх
НУКЛЕОЗИДТРИФОСФАТЫ И НУКЛЕОЗИДДИФОСФАТ-САХАРА (НДФС) АТФ, УТФ, ГТФ, ЦТФ- коферменты фосфотрансфераз (перенос ФОСФАТА,
ПИРОФОСФАТА, АМФ ИЛИ АДЕНОЗИНОВОЙ ЧАСТИ). Перенос нуклеозида аденозин на метионин с молеклы АТФ выглядит следующим образом: НУКЛЕОЗИДДИФОСФАТ-САХАРА (НДФС) УРИДИНДИФОСФАТ-ГЛЮКОЗА (УДФ-ГЛЮКОЗА) кофермент переноса остатка
углевода: УДФ-ГЛЮКОЗА + ФРУКТОЗА а УДФ
+ САХАРОЗА
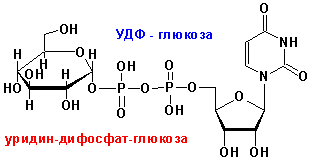
КОФЕРМЕНТ
АЦЕТИЛИРОВАНИЯ (КОЭНЗИМ А,
или просто КоА)
Наверх
УЧАСТВУЕТ В РЕАКЦИЯХ АКТИВАЦИИ И ПЕРЕНОСА АЦЕТИЛЬНЫХ И АЦИЛЬНЫХ
ГРУПП (присоединяется к S- в составе КоА, с образованием ацетил-КоА или ацил-КоА.
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
Наверх
Всего в клетке насчитывают около 10000 ферментов, которые катализируют
около 2000 реакций. Известно 1800 ферментов из них 150 выделены в кристалличнском
виде. Более подробно познакомиться с системой классификации энзимов,
а также свойствами отдельных ферментов можно здесь.
По классификации ферментов (КФ- русскоязычная, ЕС-англоязычная) каждый фермент
(энзим) имеет свой определенный номер, состоящий из четырех групп цифр, разделенных
точками. Первая цифра обозначает отнесение фермента к классу, вторая-к подклассу,
третья- к подподклассу и, наконец, четвертая- номер фермента. Например, шифр
алкогольдегидрогеназы ADH по классификации- ЕС 1.1.1.1, малатдегидрогеназы-
ЕС 1.1.1.37. Разделение ферментов на классы строгое и не допускает произвольного
изменения номеров. Так, все оксидоредуктазы относят к первому классу, трансферазы-
ко второму, гидролазы- к третьему и т.д. Классификация ферментов: четырехчисловая система, первое число-
класс (один из шести):
1. Оксидоредуктазы (катализаторы окислительно-восстановительных реакций)
2. Трансферазы (реакции переноса групп с одной молекулы на другую)
3. Гидролазы (реакции с участием молекул воды)
4. Лиазы (Синтазы) (реакции соединения или расщепления молекул, присоединения-отсоединения
воды, аммиака, СО2 и т.д.)
5. Изомеразы (изменение строения внутри одной молекулы)
6. Лигазы (Синтетазы) (то же, что 4,но с участием энергии АТФ)
Внутри каждого класса происходит разделение на подклассы, например, внутри
первого класса различают:
EC 1.1 Действующие на CH-OH группы донора
EC 1.2 Действующие на альдегидные или оксо- группы донора
EC 1.3 Действующие на CH-СH группы донора
EC 1.4 Действующие на CH-NH2 группы донора
EC 1.5 Действующие на CH-NH группы донора
EC 1.6 Действующие на NADH или NADPH
Внутри каждого подкласса происходит разделение на подподклассы:
EC 1.1.1 Акцептор NAD или NADP
EC 1.1.2 Акцептор- цитохром
EC 1.1.3 Акцептор- кислород
EC 1.1.4 Акцептор- сульфид
EC 1.1.5 Акцептор- хинон или подобная группировка
EC 1.1.99 Другой акцептор
Последнее число- номер конкретного
энзима:
EC 1.1.1.1 alcohol dehydrogenase
EC 1.1.1.2 alcohol dehydrogenase (NADP+)
EC 1.1.1.3 homoserine dehydrogenase
EC 1.1.1.4 (R,R)-butanediol dehydrogenase
EC 1.1.1.5 acetoin dehydrogenase ...
и т. д.
подробный список
всех NAD, NADP- зависимых оксидоредуктаз (ЕС. 1.1.1.ХХ) смотри здесь.
Однако стало очевидно, что ни один из классов не описывает важную группу ферментов, которые катализируют перемещение ионов или молекул через мембраны или их разделение внутри мембран. Некоторые из них включают гидролиз АТФ и ранее были классифицированы как АТФазы (ЕС 3.6.3.-), хотя гидролитическая реакция не является их основной функцией. В августе 2018 года Международный союз биохимии и молекулярной биологии (IUBMB) классифицировал эти ферменты в соответствии с новым классом ферментов (EC) транслоказ (EC 7).
Ферменты имеют названия, которые разделяются на рабочие и систематические. Рабочие названия образуются из объединения названия субстрата, типа реакции и окончания "-аза". Например: ЛАКТАТ + ДЕГИДРОГЕНизация + АЗА = ЛАКТАТДЕГИДРОГЕНАЗА. Систематическое название фермента формируется следующим образом: (название субстратов (через дробь), название типа химического превращения + аза). Та же лактатдегидрогеназа будет иметь систематическое название "L-лактат:NAD+ оксидоредуктаза".
КЛАССЫ ФЕРМЕНТОВ:
1. ОКСИДОРЕДУКТАЗЫ- катализируют реакции окисления-восстановления:
Лактатдегидрогеназа (LDH, EC 1.1.1.27) катализирует превращение молочной кислоты (лактат) в пировиноградную (пируват):
СН3СН(ОН)СООН + NAD+ а CH3COCООH + NADH + H+
2. ТРАНСФЕРАЗЫ - (РЕАКЦИИ ПЕРЕНОСА ГРУППИРОВОК С ОДНОГО СОЕДИНЕНИЯ НА ДРУГОЕ):
(холинацетилтрансфераза, ЕС 2.3.1.6, систематическое название: ацетил-КоА: холин О-ацетилтрансфераза)
СH3CO-S-KoA + HO-СН2-СН2-N+(CН3)3 а КоА-SH + СН3СОO-СН2-СН2-N+(CН3)3
3. ГИДРОЛАЗЫ (фосфатазы, эстеразы, фосфолипазы) (разрыв связей с присоединением воды):
а) Дипептидаза расщепляет дипептид на две аминокислоты при участии воды:
H2N-CH(R)-CO-NH-CH(R')-COOH + H2O а H2N-CH(R)-COOH + NH2-CH(R')-COOH
б) Холинэстераза (ЕС 3.1.1.7, ацетилхолин ацетилгидролаза)
катализирует реакцию гидролиза сложного эфира холина
и уксусной кислоты (ацетилхолина):
CH3COO-CH2-CH2-N+(CH3)3
+ H2O а CH3COOH
+ HO-CH2-CH2-N+(CH3)3
4. ЛИАЗЫ (альдолазы, гидратазы-дегидратазы, синтазы, декарбоксилазы) (катализ реакций разрыва связей в субстрате без присоединения воды или окисления):
пируватдекарбоксилаза (ЕС 4.1.1.1, 2-кетокислоты карбокси-лиаза) катализирует расщепление пирувата до уксусного альдегида с отщеплением СО2:
CH3COCООH а CH3COH + СО2
карбоксилаза (плюс СО2)
дегидратаза (минус Н2О)
Цитрат-дегидратаза (ЕС 4.2.1.4,
цитрат гидро-лиаза) катализирует отщепление-присоединение
воды от лимонной кислоты с образованием аконитата и изоцитрата:
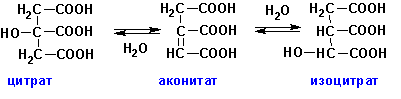
Фермент катализирует как прямые, так и обратные реакции.
синтаза (соединение двух мелких в один крупный)
Цитрат-синтаза (бывший ЕС 4.1.3.7) синтезирует
лимонную кислоту из оксалоацетата (щавелевоуксусной кислоты, ЩУК) и молекулы
Ацетил-КоА:
Приведенная выше реакция схожа с реакциями переноса групп, катализируемых трансферазами
(энзимы 2-го класса), поскольку происходит перенос ацетильной группы с Ацетил-КоА
на оксалоацетат, поэтому в настоящее время цитрат-синтаза
отнесена к энзимам этого класса, имеет номер ЕС 2.3.3.1 и систематическое название
ацетил-КоА: оксалоацетат С-ацетилтрансфераза
(acetyl-CoA:oxaloacetate C-acetyltransferase [thioester-hydrolysing,
(pro-S)-carboxymethyl forming]).
5. ИЗОМЕРАЗЫ (рацемазы, эпимеразы, мутазы) (внутримолекулярные перестройки).
Глюкозо-6-фосфат-изомераза
(ЕС 5.3.1.9, D-глюкозо-6-фосфат кето-изомераза),
например, превращает глюкозо-6-фосфат во
фруктозо-6-фосфат и наоборот:
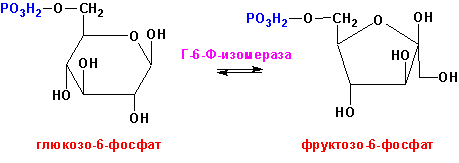
6. ЛИГАЗЫ (синтетазы, соединяют 2 части с использованием энергии АТФ). Реакции ферментов этого класса, как правило, необратимы.
Так, аспартат-синтетаза (ЕС 6.3.1.1, L-аспартат: аммиак-лигаза (АМФ-образующая) при участии молекулы АТФ синтезирует аспарагин из аспарагиновой кислоты и аммиака:
К подклассу 6.1 относят ферменты, катализирующие образование связей С-О (в том числе Аминоацил-т-РНК-синтетазы), к подклассу 6.2- образование связей C-S, 6.3- связей C-N, 6.4- связей С-С и 6.5- связей Р-О.
Например, к подклассу 6.4 относится фермент пируваткарбоксилаза (ЕС 6.4.1.1, пируват: СО2-лигаза (АДФ-образующая), при участии которой происходит превращение пирувата в оксалоацетат:
СО2 + СН3-СО-СООН + АТФ --> HOOC-CH2-CO-COOH + АДФ + Н3РО4
ВЕРНУТЬСЯ НА НАЧАЛЬНУЮ СТРАНИЦУ