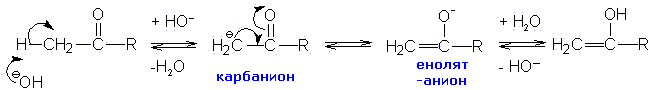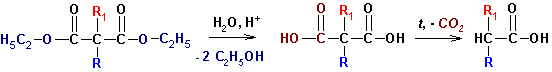|
Томский
государственный университет
|
|
кафедра
органической химии
|
Присоединение карбаниона или другого нуклеофила к карбонильному соединению или другому электрофилу с последующим отщеплением воды носит название реакции конденсации. Более общее определение гласит: реакция конденсации- это реакция, приводящая к изменению углеродного скелета и сопровождающаяся увеличением числа атомов углерода путем образования новых углерод-углеродных связей.
В еще более упрощенном виде реакции конденсации можно представить как реакции присоединения к двойной связи "углерод-кислород" (карбонильная группа):
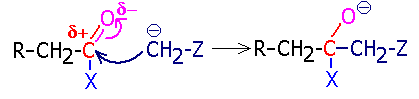
Дальнейшее направление реакции будет зависеть от природы группы Х (соседней с карбонильной группой). Если при ее отщеплении получается относительно слабое основание (легко уходящая группа),
то реакция завершается ее уходом и представляет, по сути, реакцию замещения:
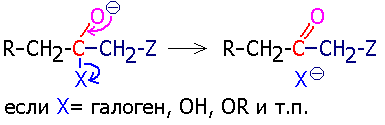
Так
протекают, в частности, реакции сложноэфирной конденсации. Если группа Х не способна при отрыве образовать относительно слабого основания, то она вовсе не отрывается,
а реакция завершается захватом протона от молекулы воды (или другой молекулы, способной отщепить протон) и регенерацией основания:
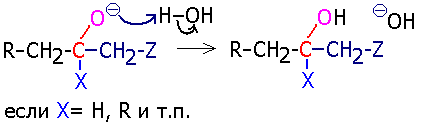
Такое течение реакции характерно при конденсации альдегидов и кетонов (см. Альдольно-кротоновая конденсация). Частным случаем ее является реакция диспропорционирования Канниццаро (см.), когда
отщепляющийся гидрид-ион переходит на соседнюю молекулу карбонильного соединения, восстанавливая ее до спирта. По такой же схеме протекает сопряженное присоединение (к системе связей -С=С-С=О) по Михаэлю. Обычно
реакция присоединения в дальнейшем сопровождается отщеплением молекулы воды. Вероятно, такому исходу благоприятствует образование сопряженной ненасыщенной системы.
В общем случае участие карбанионов в реакциях конденсации можно записать в виде следующей схемы:
а) образование карбаниона:
X-CH2-Y + B- (или В:) = X--CH-Y + BH (или ВН+)
б) реакция карбаниона с карбонильным соединением:
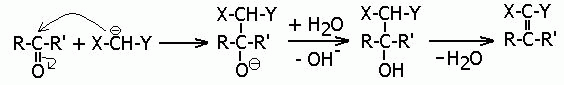
Из этой общей схемы вытекают следующие важные замечания:
1. Общая стехиометрия реакции проста:
X-CH2-Y + R-CO-R' ------ RR'C=CXY + H2O
Таким образом, если основание связывается на стадии, определяющей скорость реакции (т.е. его концентрация определяет скорость реакции), оно не расходуется в течение реакции, а регенерируется на последней стадии. Поэтому для проведения реакции совсем не обязательно стехиометрических количеств основания, а достаточно каталитических.
2. Для проведения конденсации
можно использовать более слабое основание, чем при алкилировании или ацилировании,
поскольку соединение X-CH2-Y
не обязательно должно быть полностью переведено в карбанион до введения в реакцию
с карбонильным соединением.
3. Так как теоретически все стадии обратимы, то для более полного прохождения реакции полезно удалять воду, образующуюся на последней стадии.
4. Если система содержит более одного источника карбанионов и (или) более одной карбонильной группы, конденсация будет идти главным образом за счет атаки наиболее стабильным анионом самого электрофильного карбонильного углерода.
С-Н Кислоты. (наверх)
Соединения с относительно подвижным
атомом водорода при углеродном атоме носят название С-Н кислот. С-Н кислоты
часто являются источниками карбанионов, используемых в реакциях конденсации.
Сила таких кислот значительно варьирует в зависимости от наличия при атоме углерода
электроноакцепторных замещающих групп. Наиболее сильными кислотами такого рода
являются нитроалканы (рКа около 9-10), далее следуют соединения типа Y-CH2-X,
где Х и Y- электроноакцепторные группы (рКа < 13), и более слабые- с одной
электроноакцепторной группой R-CH2-X (pKa
в интервале 19-27).
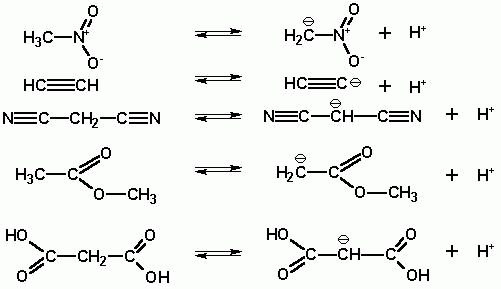
Таким образом, даже сравнительно
сильные основания, подобные алкоголятам натрия, могут создавать лишь некоторую
равновесную концентрацию карбаниона этих соединений. Чтобы полностью перевести
такие соединения в карбанионы, необходимо использовать гораздо более сильные
основания, например, амиды щелочных металлов. При этом в качестве растворителей
нельзя использовать спирты, поскольку спирты более слабые основания, чем СН-кислоты
и, следовательно, депротонируются легче
последних.
Из всего сказанного выше следует, что если группы X и Y обладают -М-эффектом (электроноакцепторные), реакции конденсации альдегидов и кетонов будут протекать в присутствии относительно слабых оснований. Амины, такие, как пиперидин, способны до определенной степени депротонировать диэтилмалонат, ацетоуксусный эфир и подобные им соединения. Благодаря этому пиперидин и другие амины с успехом катализируют конденсацию с альдегидами и кетонами высокостабильных карбанионов (общеизвестные под названием реакции Кневенагеля):
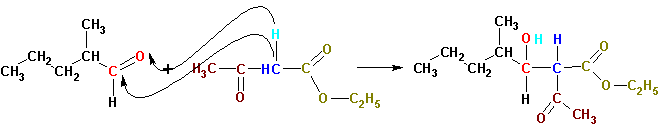
Даже когда имеется альдегид типа
RCH2CHO, который теоретически
может вступать в реакцию самоконденсации, амины не являются достаточно сильными
основаниями, чтобы обеспечить существенную равновесную концентрацию R--CH-CHO
, поэтому самоконденсация редко протекает в заметной степени.
Если альдегиды вступают в реакцию
конденсации Кневенагеля с самыми различными источниками карбанионов (иначе называемыми
активными метиленовыми соединениями), то этого не происходит с кетонами. Простые
кетоны конденсируются по Кневенагелю с малонитрилом СН2(CN)2
и этиловым эфиром циануксусной кислоты, реже- с
диэтилмалонатом или ацетоуксусным эфиром. Отличительной чертой реакции Кневенагеля
является повышение выходов либо при добавлении в реакционную смесь каталитического
количества органической кислоты, либо при использовании в качестве катализатора
аммонийной соли (обычно ацетата) вместо свободных аминов. Точный механизм действия
кислоты остается неясным. Возможно, она способствует образованию высокоэлектрофильной
иминиевой соли из карбонильного соединения и амина:
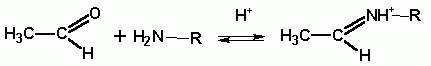
Кроме того, она может ускорять дегидратацию, которая является
конечной стадией реакции конденсации. (наверх)
Другим важным вариантом конденсации по Кневенагелю является
тот, когда одна (или обе) -М -группы, стабилизирующие карбанион, являются карбоксильными
(-СООН). В этом процессе, известном под названии конденсации Дебнера,
карбанионы поставляет малоновая (X= COOH) или циануксусная (X= CN) кислоты,
а растворителем служит пиридин или хинолин.
RR'C=O + X-CH-COOH --> RR'C=CX-COOH + H2O
В конденсацию Дебнера могут также вступать алкилмалоновые кислоты:
Ph-CHO + CH3CH(COOH)2 ----------- Ph-CH(OH)-C(COOH)2CH3
Иногда случается, что конденсация по Кневенагелю простого
альдегида, например, с диэтилмалонатом приводит не к простому продукту конденсации,
а к такому, когда 1 моль альдегида взаимодействует с 2 молями малоната.
В этой реакции первой стадией является конденсация по Кневенагелю (наверх)
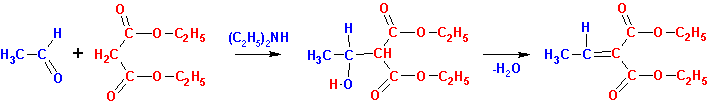
но в дальнейшем к продукту конденсации (a, b - ненасыщенному эфиру) сопряженно присоединяется второй моль карбаниона, образованного
из малоната. Таким образом возникает енолят-ион, который при протонировании
дает конечный продукт:
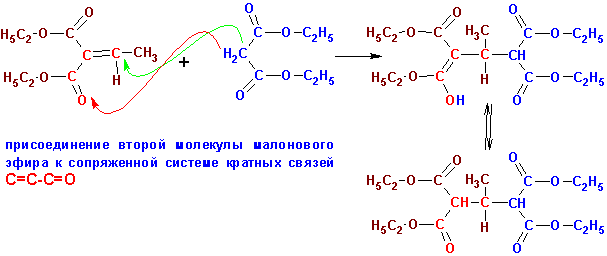
Подобное сопряженное присоединение стабилизированного карбаниона
к a, b- ненасыщенному
карбонильному и активированному (либо циано-, либо нитро-) соединению широко
распространено и носит название реакции Михаэля. В данном случае нет
необходимости в стехиометрическом количестве основания.
Енолизация, катализируемая кислотой. (наверх)
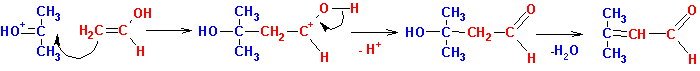
Очень часто реакции конденсации протекают с участием в качестве промежуточных соединений- енолов. При этом образование енола может катализироваться кислотой согласно нижеприведенной схеме (R'= алкил или Н):
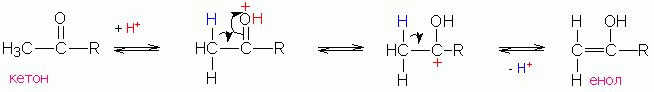
В конденсацию вступают енол и протонированная карбонильная
группа второй молекулы соединения:
Енолизация, катализируемая основанием.
Образование енолят-иона, генерирующего карбанион, протекает по схеме:
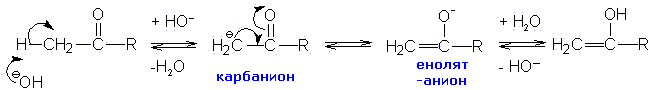
Далее карбанион присоединяется к карбонильной группе второй
молекулы, причем протекает С-алкилирование, в отличие от термодинамически невыгодного
О- алкилирования:
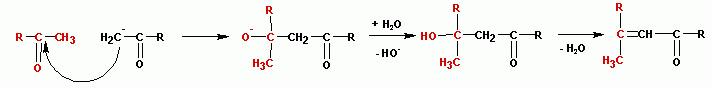
Альдольное присоединение и кротоновая конценсация.
(наверх)Альдольное присоединение очень напоминает реакцию образования
ацеталей и, строго говоря, не является реакцией конденсации, поскольку не сопровождается
выделением воды. Образующийся альдегидоспирт (альдоль) легко теряет воду в присутствии
каталитических количеств оснований или кислот, а также при незначительном нагревании,
с образованием альфа, бетта- ненасыщенного карбонильного
соединения, этим завершается реакция конденсации (R,Х= алкил или Н):
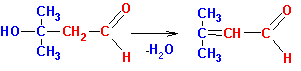
Таким образом, в реакцию кротоновой конденсации (в том числе
и самоконденсации) могут вступать как альдегиды, так и кетоны, имеющие альфа-углеродные
атомы водорода. В случае кетонов положение равновесия невыгодно для образования
продуктов, тем не менее, проводя реакцию в особых условиях (например, исключая
контакт продукта с катализатором основного характера) можно добиваться существенных
выходов. Перекрестные реакции между альдегидами и кетонами не имеют лабораторного
применения, поскольку образуется трудноразделяемая смесь из четырех продуктов
и непрореагировавших исходных соединений. Чаще в синтетических целях проводят
реакцию между двумя карбонильными соединениями, одно из которых является источником
карбанионов (метиленовая компонента), а другое служит карбонильной компонентой
(не имеющей альфа-углеродных атомов водорода). Обычно в роли карбонильной компоненты
используются формальдегид, ароматические альдегиды, эфиры угольной, щавелевой
и муравьиной кислот. В качестве метиленовой компоненты применяют в том числе
и С-Н кислоты и даже производные ацетиленовых углеводородов с концевой тройной
связью.
Образующиеся альфа, бетта- ненасыщенные карбонильные соединения
способны вступать в реакцию конденсации по Михаэлю (см. выше), с образованием
полиненасыщенных продуктов.
Реакция Канниццаро
(наверх)
Альдегиды, не имеющие альфа-углеродных атомов водорода при
нагревании с сильными основаниями вступают в реакцию окисления-восстановления,
когда одна из молекул восстанавливается до спирта за счет окисления второй молекулы
до карбоновой кислоты. Такие реакции носят название реакции Канниццаро, и протекают
по схеме:
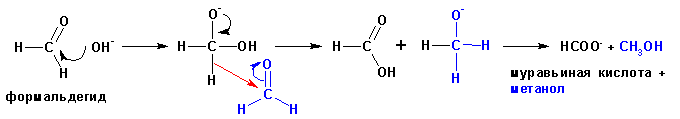
Известны и внутримолекулярные реакции окисления-восстановления:
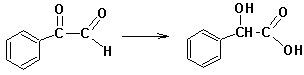
Cвоеобразной разновидностью внутримолекулярного окисления-восстановления является Бензиловая перегруппировка:
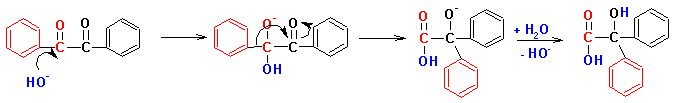
Бензоиновая конденсация
Cамоконденсация ароматических альдегидов в присутствии цианидов носит название бензоиновой конденсации:
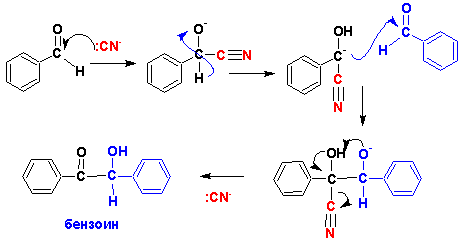
В бензоиновую конденсацию не вступают ароматические альдегиды,
содержащие в кольце сильные электроноакцепторные или электронодонорные заместители.
Сильные электроноакцепторы снижают реакционную способность (нуклеофильность)
циангидрина, а сильные электронодоноры понижают электрофильность карбонильного
углерода второй молекулы бензальдегида, выступающей в качестве "карбонильной
компоненты" реакции.
Конденсация Перкина (наверх)
Конденсация ароматических альдегидов с ангидридами карбоновых кислот, катализируемая солями этих кислот, аминами или основаниями, носит название реакции Перкина:
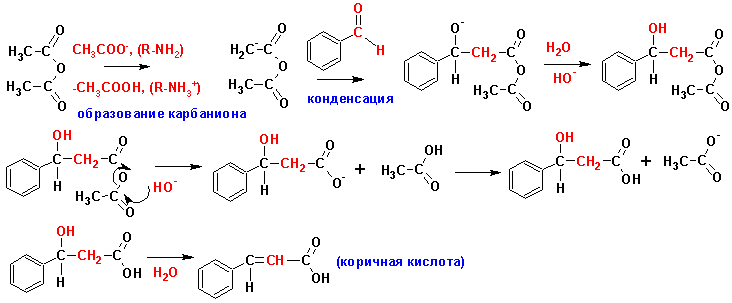
Кляйзена-Шмидта реакция (наверх)
Такое название носит реакция конденсации ароматических альдегидов с алифатическими карбонильными соединениями:
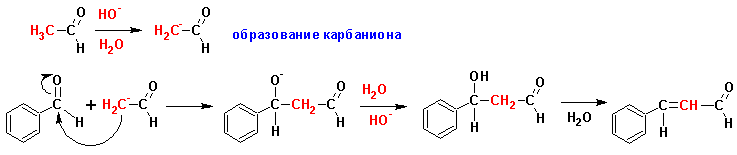
CЛОЖНОЭФИРНАЯ КОНДЕНСАЦИЯ (наверх)
Реакции конденсации сложных эфиров весьма схожи по схеме с
конденсацией других карбонильных соединений. Одна молекула сложного эфира является
карбонильной компонентой, другая- метиленовой. Простейший пример- самоконденсация
этилацетата, приводящая к ацетоуксусному эфиру и катализируемая алкоголятом,
соответствующим спирту в сложном эфире:
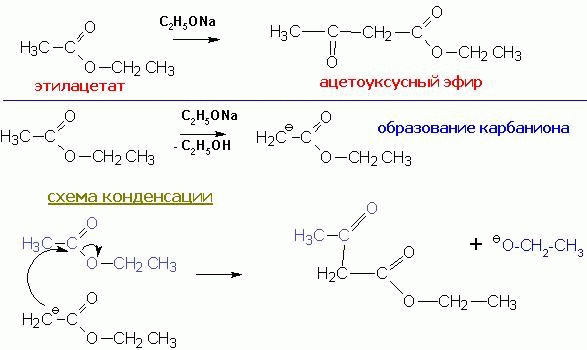
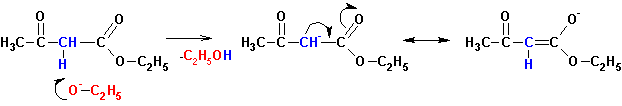
Для успешного протекания реакции в продукте конденсации должен
присутствовать, как минимум, один альфа-углеродный атом водорода. Обладая повышенной
кислотностью он легко отщепляется при взаимодействии с алкоголятом с образованием
енолят-аниона, смещая равновесие реакции в сторону образования продукта:
Конденсация Дикмана
(наверх)
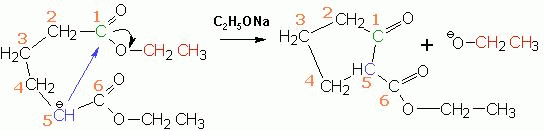
Внутримолекулярная сложноэфирная конденсация носит название
конденсации Дикмана. В эту реакцию вступают эфиры дикарбоновых кислот, реакции
протекают, если в результате получаются малонапряженные пяти- и шестичленные
циклы:
Кетонное и кислотное расщепление кетоэфиров (наверх)
Полученные в результате конденсации бетта-кетоэфиры карбоновых
кислот используются в качестве полупродуктов синтеза карбоновых кислот и кетонов,
достраивая требуемый углеродный скелет алкилированием или ацилированием кетоэфиров.
При обработке кетоэфиров алкоголятами наблюдается реакция, обратная сложноэфирной
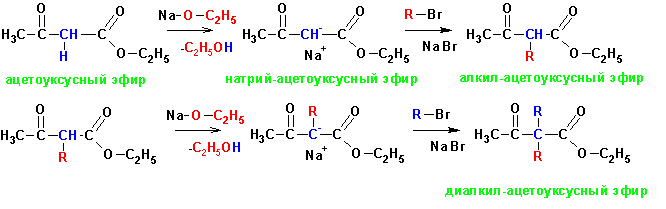
конденсации, с образованием эфиров карбоновых кислот. Получение производных
ацетоуксусного эфира:
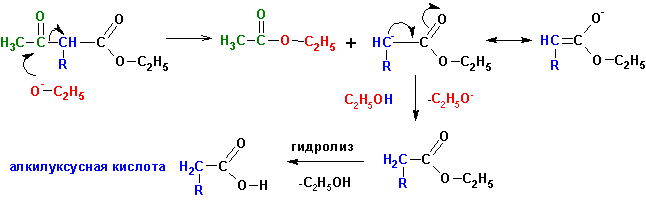
Кислотное расщепление (получение карбоновых кислот):
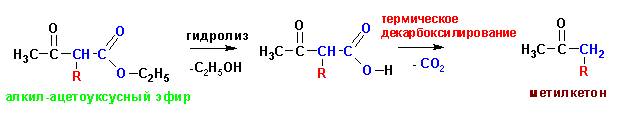
Кетонное расщепление (получение метилкетонов):
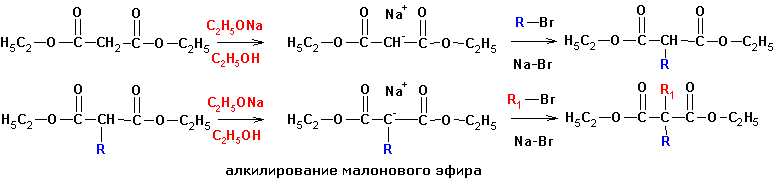
На основе малонового эфира также возможно получение различных
карбоновых кислот. Вначале получают производные малонового эфира алкилированием
натрий-малового эфира. Этот метод имеет ограниченное применение вследствие невозможности
получения продуктов моноалкилирования (за исключением введения разветвленных
алкильных групп):
Карбоновые кислоты (производные уксусной кислоты) получают
омылением эфира и термическим декарбоксилированием двухосновной кислоты:
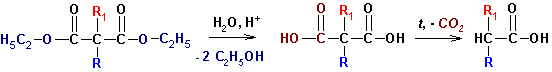
При такой обработке сам малоновый эфир дает уксусную кислоту.
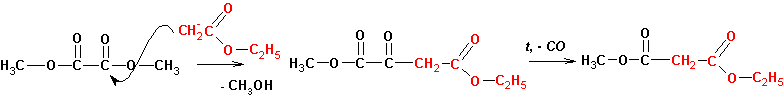
В синтетических целях широко применяют конденсации сложных
эфиров с эфирами щавелевой и угольной кислот, термическое декарбонилирование
(- СО) продуктов такой конденсации приводит к получению нового ряда соединений: (наверх)
Ацетоуксусный эфир можно использовать для получения дикарбоновых
кислот и дикетонов. Пример такого синтеза приведен ниже. На первом этапе проводится
обработка эфира основанием, в качестве которого чаще всего используется этилат
натрия. При этом образуются натрий-ацетоуксусный эфир:
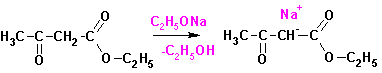
Полученное соединение путем алкилирования может быть модифицировано.
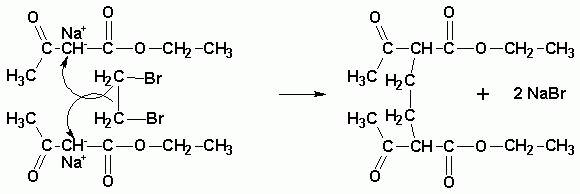
Если применять короткие дигалоидные алкилы, в результате могут быть проалкилированы
сразу две молекулы эфира:
Если используются достаточно длинные дигалогеналкилы, например,
1,4-дихлорбутан или 1,5-дибромпентан, то возможно алкилирование одной молекулы
эфира и образование циклоалкильного производного. Подвергая полученные производные
эфиров кислотному расщеплению (последовательной обработкой этилатом натрия
с последующим кислотным гидролизом диэфира):
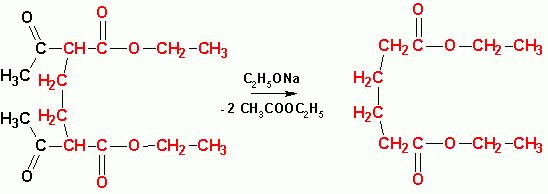
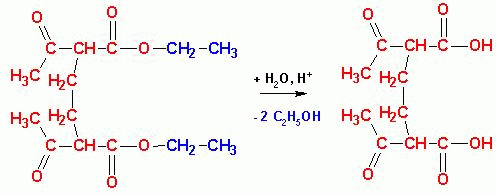
можно получить двухосновные кислоты. Если провести кетонное
расщепление (вначале гидролиз, затем- термическое декарбоксилирование), получаются
дикетоны:
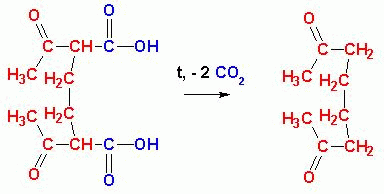
В данном случае из ацетоуксусного эфира и 1,2-дибромэтана получен октандион-2,7.
ВЕРНУТЬСЯ НА НАЧАЛЬНУЮ СТРАНИЦУ