| томский государственный университет |
| кафедра органической химии |
|
Миоглобин и гемоглобин. Транспорт кислорода
|
Миоглобин- сложный белок третьего
уровня структурной организации. Состоит из одной полипептидной цепи (153 остатка).
Третичная структура белка образована, главным образом, альфа-спиралями вторичной
структуры, на которые приходится около 70 процентов АКО, остальные- на повороты
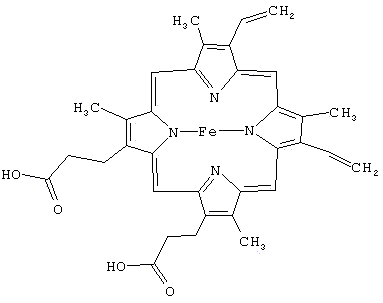
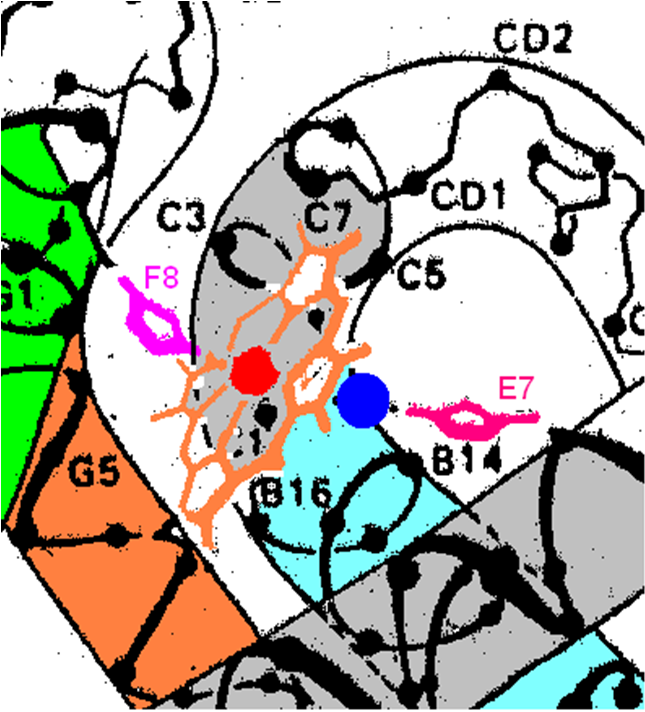
и начальный и конечный участки. Белок содержит в себе так называемый ГЕМ- комплекс
порфирина и иона железа в степени окисления +2.
Миоглобин сосредоточен, главным
образом, в мышцах и его главной функцией
является хранение кислорода. Скорость насыщения миоглобина кислородом намного
превышает таковую для гемоглобина. Миоглобин мало приспособлен для транспортировки
кислорода из легких в ткани, поскольку скорость отдачи кислорода в тканях невелика
(при давлении 1 мм рт. ст. примерно половина миоглобина все еще не отдает кислород).
|
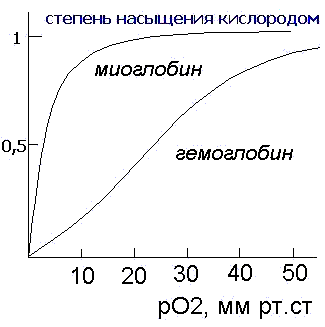 |
Вопросы транспортировки кислорода решаются при участии белка четвертичной структуры- гемоглобина.
ГЕМОГЛОБИН
Гемоглобин представляет собой
белок четвертичной структуры, состоящий из двух пар субъединиц альфа-
(141
АКО) и бетта- (147 АКО- аминокислотных остатков). Субъединицы миоглобина и гемоглобина
очень сходны между собой, как весьма сходна и третичная структура обоих белков.
Главное отличие гемоглобина от миоглобина заключается в проявлении особого рода эффектов- кооперативных, влияющих на скорости присоединения- отсоединения молекул кислорода. Каждая молекула гемоглобина способна присоединять и переносить четыре молекулы кислорода, при этом кооперативность проявляется в том, что как присоединение, так и отсоединение каждой последующей молекулы кислорода облегчается в результате структурных изменений в конформации молекулы, которых у гемоглобина имеется две основных- оксигенированная и дезоксигенированная. Промежуточные состояния нестабильны. Предполагается следующий механизм кооперативного эффекта. Присоединение первой молекулы кислорода приводит тому что атом железа смещается от своего места примерно на 0,4-0,6 ангстрем, вызывая изменения конформации субъединицы. Изменившаяся конформация по аллостерическому эффекту облегчает присоединение кислорода к другой субъединице и т.д. Это позволяет максимально ускорить процесс присоединения кислорода в легких (рО2 = 100 мм рт. ст.). При переносе оксигенированного гемоглобина в капилляры тканей (рО2 = 5 мм рт. ст.) отсоединение молекул кислорода протекает также быстро, по кооперативному эффекту. Известны, впрочем, и химические регуляторы скорости и полноты присоединения кислорода. К ним, в частности, относится 2,3- дифосфоглицериновая кислота. Она облегчает присоединение кислорода у организмов, обитающих в высокогорных районах.
Формы гемоглобина
ОКСИГЕМОГЛОБИН (HbO2) - полностью оксигенированный гемоглобин, содержащий 4 молекулы О2. Из шести sp3d2 гибридизованных орбиталей Fe2+ ЧЕТЫРЕ связаны в комплексе с порфирином, ОДНА- с остатком His (внутрь молекулы), а ОДНА свободная- присоединяет О2 или ПУСТА (дезокси-Нb).
КАРБАМИНОГЕМОГЛОБИН.
Hb-NH2 + CO2
---> Hb-NH-COO- + H+ (с N- концевыми остатками ПП-цепей).
Таким образом транспортируется только 32 % СО2, 60 % СО2- с венозной кровью, после превращения СО2 в Н2СО3 при помощи КАРБОАНГИДРАЗЫ, и лишь около 8 % транспортируется в эритроцитах в виде НСО3_.
КАРБОКСИГЕМОГЛОБИН (HbCO)-
образуется в результате присоединения к гемоглобину окиси углерода СО, образуя
светочувствительный НbСО синего цвета. Поскольку присоединение СО протекает
в 200 раз быстрее, чем присоединение кислорода, достаточно незначительных концентраций
СО в атмосфере, чтобы вызвать превращение значительной доли гемоглобина в HbCO.
Смерть наступает при связывании >70 % Нb.
Для снятия эффекта требуется увеличение парциального давления кислорода во вдыхаемом
воздухе.
МЕТГЕМОГЛОБИН
(Met-Hb). Пероксиды, феррицианиды, окислы азота
и хинон окисляют железо в геме до Fe3+, при этом нарушается транспорт О2
и СО2. Однако, это нарушение
обратимо и менее опасно, чем НbСО, поскольку железо легко превращается
ферментами обратно в Fe2+.
ФУНКЦИИ ГЕМОГЛОБИНА:
1. Транспорт О2 и СО2.
2. Создание буферной емкости крови
и поддержание рН в строго определенных пределах (7,40+0,02).
Гемоглобинопатии
Серповидноклеточная анемия-
патология, вызванная наличием аномального гемоглобина, с измененной структурой
белка глобина, а точнее- его b-цепи.
Происходит это вследствие замены в мРНК кодона ГАГ (кодирует Глутаминовую
кислоту) на ГУГ (кодирует аминокислоту
Валин).
В результате получается гемоглобин S, называемый
HbS, с измененными свойствами зарядов на
поверхности. Поскольку замена остатка глутаминовой кислоты по положению 6 в
b-цепи на остаток
с гидрофобным незаряженным боковым радикалом валина приводит к утрате отрицательного
заряда и слипанию молекул гемоглобина, форма эритроцитов становится похожей
на серп при рассматривании под микроскопом. Деформированные эритроциты отличаются
плохой способностью присоединять кислород и проникать в тончайшие капилляры,
что вызывает в ряде случаев кислородное голодание тканей.
Мутация является типичным примером
эволюционного приспособления организма к возбудителям малярии. Гемоглобин S
наиболее часто обнаруживается у выходцев из экваториальной Африки, где малярия
широко распространена. Гетерозиготные по гемоглобину S
люди невосприимчивы к малярии и к тому же у них не проявляются симптомы кислородного
голодания, обнаруживаемые у гомозигот. Возбудитель малярии не выживает в эритроцитах,
содержащих гемоглобин S.
Симптомы заболевания, вызываемое
аномальным гемоглобином S,были впервые описаны
в Чикаго в 1904 году при осмотре негра-выходца из Африки, однако причина болезни
была установлена многими годами позднее. Впоследствии было выявлено множество
других аномальных гемоглобинов, вызываемых заменой аминокислотных остатков.
Подавляющее большинство из них, впрочем, никак не проявляется на состоянии человека.
Аномальные гемоглобины получают название по замене аминокислотных остатков и
местности, где аномалия впервые была обнаружена. Так, гемоглобин S еще
имеет название Чикаго b-6
Глу-->Вал.
Клиническая диагностика осуществляется
процедурой Southern Blot. Ген, кодирующий
бетта-цепь нормального глобина, имеющего последовательность аминокислотных остатков
5-7 (Про-Глу-Глу)
несет соответствующие триплеты кодонов ЦЦТ-ГАГ-ГАГ. У носящих дефектный ген
эта последовательность имеет замену аденозинового нуклеотида (А) в среднем триплете
на тимидиловый (Т). Рестрикционный энзим MstII
узнает и расщепляет последовательность ЦЦТ-ГАГ-Г, но не узнает измененной последовательности
в мутировавшей ДНК. Соответственно, обработка ДНК рестриктазой
MstII с последующим анализом может
обнаружить эти различия и выявить патологию еще до рождения плода, у эмбриона.