Химические свойства аминов
Взаимодействие первичных аминов.
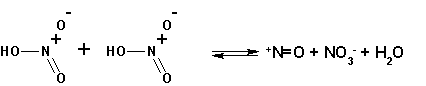
Под диазотированием понимают превращение первичных алифатических или ароматических аминов в соли диазония ( R - + N = NX – ). Реакция выполняется прибавлением первичного амина к охлажденному (0+5 С) раствору нитрита натрия в разбавленной серной или соляной кислоте.
На первой стадии образуется нитрозамин (R-NH-N=O), который в дальнейшей последовательности реакций превращается в соль диазония. Если амин вторичный, то реакция останавливается на этой стадии. Нитрозопроизводные первичных аминов неустойчивы и превращаются дальше.
а) алифатические амины
- образование нитрозоний-катиона:

- взаимодействие нитрозокатиона с амином с образованием диазогидрата R - N = N - OH :
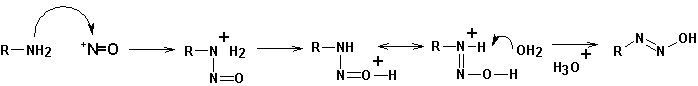
Полученный диазогидрат способен в кислой среде образовывать диазоний-катион, а в щелочной- диазотат- анион. Изменением рН среды можно переводить одно соединение в другое и обратно:
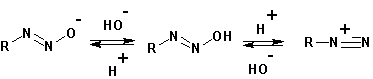
Если диазотат-анион относительно устойчив, то этого нельзя сказать о диазоний-катионе. Последний способен, отщепляя молекулу азота, превращаться в фенил- (ароматические амины) или карбкатион (алифатические первичные амины). Оба являются весьма активными интермедиатами, активно реагирующими с окружающими нуклеофилами, давая в результате смесь продуктов.
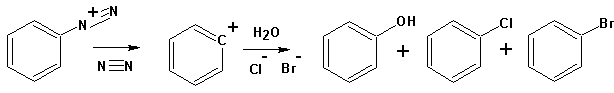
Алифатические карбкатионы, кроме того, претерпевают перегруппировку углеродного скелета, отщепляют протон и т.д.
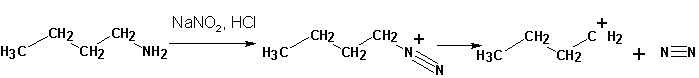
Так, из первичного карбкатиона немедленно образуется вторичный и все характерные для него продукты S N 1 реакции:
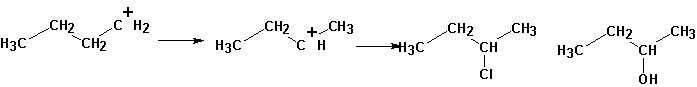
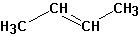
Включая продукты отщепления протона- алкены:
Образуется и значительное количество продуктов реакции первичного карбкатиона:
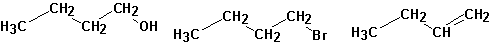
б) ароматические амины
Таким образом, диазотирование алифатических аминов практического значения не имеет, а вот диазотирование анилина и его производных широко используется в синтетических целях. Этому способствует бОльшая устойчивость ароматических диазосоединений. Устойчивость увеличивается, если в кольце присутствуют электронодонорные заместители. Напротив, реакционная способность увеличивается при наличии в кольце в о- и п- положениях электроноактепторных заместителей:

Различают две группы реакций, в которые вступают диазониевые соли:
1. Реакции с выделением азота
2. Реакции без выделения азота
Реакции с выделением азота
Существует ряд синтетических приемов получения соединений различных классов путем замены диазогруппы на другую группировку или водород. Например
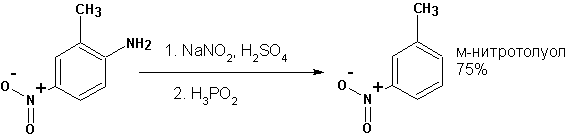
Таблица
Реакции замещения ароматических диазониевых ионов
На что замещается аминогруппа |
Реагент |
Водород (Н) |
Н3РО2 , этанол (восстановление) |
Хлор, бром, цианогруппа ( Cl , Br , CN ) |
CuCl , CuBr , CuCN (реакция Зандмейера) |
Фтор ( F) |
HBF 4 (реакция Шимана) |
Иод ( I) |
KJ |
Гидроксильная группа (ОН) |
Водная кислота |
Реакции азосочетания
Диазоний-катион может являться электрофильным агентом и вступать в реакции сочетания с активированными ароматическими системами.
В реакциях различают два компонента- диазосоставляющую (соль диазония) и азосоставляющую (активированную ароматическую систему). Реакция протекает тем успешнее, чем более обогащена электронами ароматическая система азосоставляющей и чем более электрофильна диазосоставляющая. Наиболее реакционноспособные диазосоставляющие образуются в жестких условиях. При сочетании происходит электрофильная атака активированной ароматической системы атомом азота и выделения азота не происходит. Атаке подвергаются положения, наиболее обогащенные электронной плотностью:
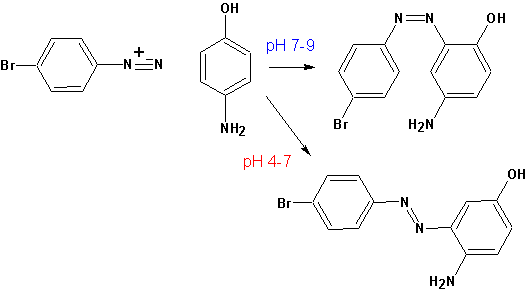
При рН>7 гидроксильная группа ионизирована, хотя и в незначительной степени. Однако, этого достаточно для ориентации реакции сочетания по о- положению относительно гидроксильной группы, поскольку в ионизированном состоянии она является сильным донором электронов по мезомерному эффекту (+М).
При рН<7 более активным донором электронов становится аминогруппа (+М- эффект выражен сильнее, чем у ОН-группы, вследствие меньшей электроотрицательности азота), поэтому сочетание (замещение) идет в о-положение относительно аминогруппы.
Расщепление связи азот-углерод
Расщепление аминов по Гофману .
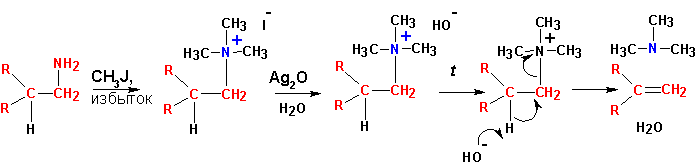
Элиминирование по Гофману при наличии выбора протекает с образованием алкена из алкильного остатка, имеющего наименее замещенный бета- углеродный атом (более предпочтительно образование этилена, нежели пропилена, при одновременном наличии этильного и пропильного радикалов:
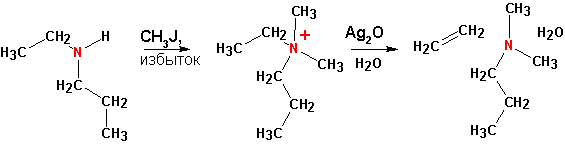
Элиминирование по Коупу. ( Cope elimination ).
Третичные амины подвергают окислению перекисью водорода, а образующиеся окиси аминов нагревают:
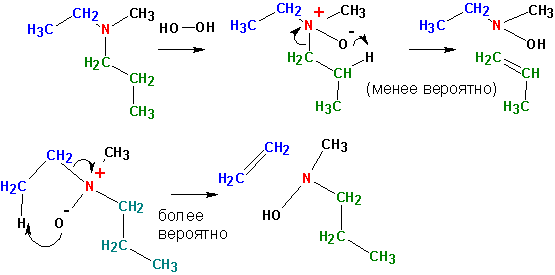
Если существует более одного варианта отщепления протона, то состав продуктов в точности соответствует числу доступных атомов водорода в бета- положении.
ВЕРНУТЬСЯ НА НАЧАЛЬНУЮ СТРАНИЦУ
Номенкалатура и получение аминов